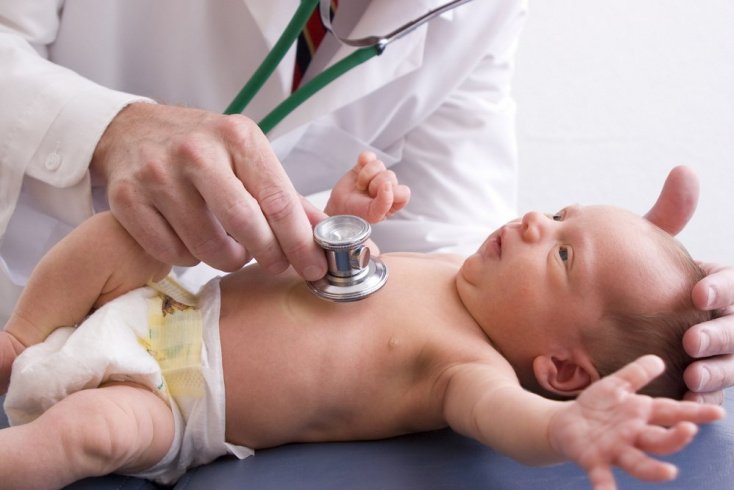
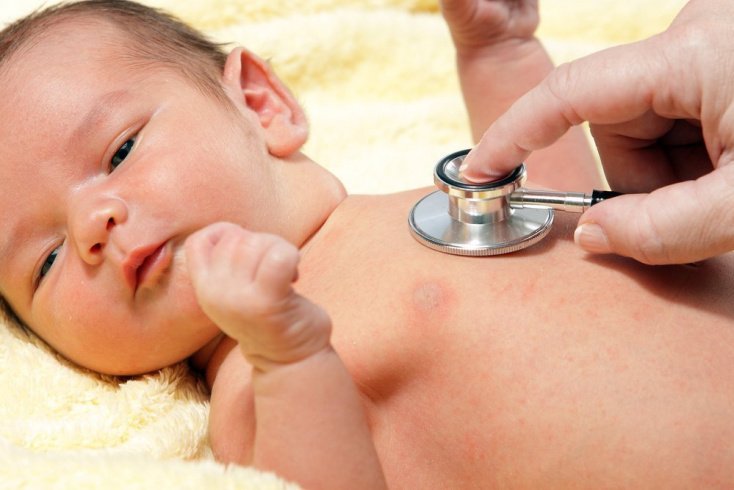
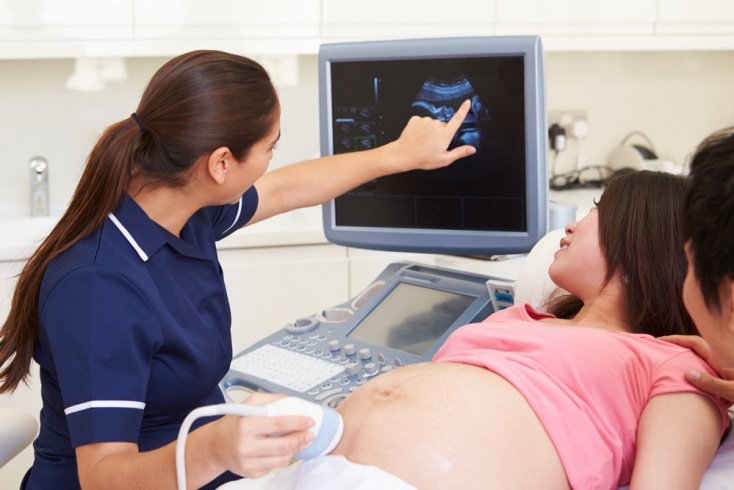
Анализ крови во время беременности сдается женщинами многократно, при этом направленность он может иметь самую разную. Сдается кровь и на ВУИ при беременностях. Это важно с точки зрения возможного инфицирования женщины и ее плода. Внутриутробные инфекции в свою очередь опасны развитием целого ряда осложнений.
Под инфекцией, присутствующей во время внутриутробного развития плода, понимается присутствие в женском организме возбудителей, которые в разных участках организма приводят к старту воспаления. Проблема такой инфекции в том, что присутствует риск плодного заражения. Инфицирование чаще всего происходит из-за того, что инфекция попадает в кровь. Однако внутриутробные инфекции могут передаваться и в момент родоразрешения при загрязненных половых путях или заглатывании вод, которыми окружен плод, в которых тоже может присутствовать инфекция.
Какие же инфекции могут обнаружить беременные. Вид инфекции связан с возбудителем, которым поражается организм будущей матери во время беременности, что логично, но и до нее. Причиной инфекции могут становиться:
Риск проблем от таких возбудителей с негативной точки зрения усиливается, если у женщины присутствуют заболевания, протекающие в хронике, если присутствует работа или жизнь во вредных условиях, вредные привычки, какие-то инфекции, не вылеченные до беременности. Особенная опасность возникает в том случае, если с инфекцией мать столкнулась впервые во время вынашивания малыша.
Часто анализы на ВУИ именуют анализами на TORCH-инфекции. Сокращение это связано с наименованием инфекций, на которые и сдают кровь или мочу. Речь идет о токсоплазмозе, краснухе, цитомегаловирусной инфекции, герпесе и других инфекционных заболеваний, сформированных в одну группу.
Важно отметить, что примерно десять процентов от всех беременностей приводят к передаче инфекции ребенку. При этом полпроцента детей рождаются сразу с первыми признаками инфекции.
Важно подчеркнуть, что если при проверке на инфекции во время беременности был продемонстрирован положительный результат по каким-то пунктам, это не говорит о стопроцентной гарантии передачи инфекции вашему ребенку.
Сдавать же анализы на инфекции при беременности нужно из-за того, что часто признаки ВУИ смазанные или отсутствуют вовсе, а значит, лечение не выполняется своевременно. При этом предоставление его в достаточном объеме может не только снизить, но и вовсе исключить риски заражения ребенка.
Какие существуют пути заражения ребенка? Выделяется врачами три основных способа. Это трансплацентарный или по-другому гематогенный. Таким образом работают вирусы, простейшие, бактерии. Речь идет о том, что возбудитель оказывается в материнской крови, через которую проникает сквозь барьер, который формирует плацента.
Если происходит такое в 1 триместр, то со временем у ребенка могут развиться уродства и разнообразные пороки. Если инфекция проникает в плод в третий триместр, то новорожденные обычно рождаются с проявлениями признаков острого ее течения. Если попадание было непосредственно в кровь ребенка, то поражение может иметь генерализованную форму.
Восходящий способ инфицирования характерен для инфекций, затрагивающих половые пути. Из них она переходит к ребенку. Обычно фиксируется это в период, когда разрываются оболочки, окружающие плод, наступают роды. Однако столкнуться с этим можно и в период непосредственного вынашивания ребенка. Основная причина ВУИ – это инфицирование вод, которыми окружен плод. Следствием такого пути передачи становится поражение кожи, нарушение в плане формирования у плода пищеварительного тракта и его дыхательной системы. В случае с нисходящим инфицированием инфекция спускается к плоду сквозь трубы матки.
Чтобы понять, есть ли у будущей матери инфекции, сдают комплекс анализов. Это в первую очередь мазки с половых органов. Они отправляются на проверку по системе ПЦР, что помогает обнаружить ДНК различных возбудителей. Кроме этого, сдается кровь, чтобы исключить у вас присутствие сифилиса, гепатита или ВИЧ.
Очень часто инфекции опасны тем, что протекают они скрыто, почему и обязательно проводится тестирование. Порой нужно выполнить 2-3 теста, чтобы обнаружить тот или иной инфекционный агент. Так в моче при беременности могут не фиксироваться инфекционные признаки, но будут обнаружены они в мазке.
Если речь идет о проверке на инфекции посредством сдачи крови, то главным «семафором» в таком случае становятся антитела группы M и G. Если анализ выявит у вас только антитела, относящиеся к группе G, то волноваться не стоит. Антитела этой группы говорят о том, что вы болели чем-то в прошлом, в результате чего ваш организм сформировал иммунитет. Соответственно, в данный момент инфекция неспособна навредить вам, а значит, и будущему ребенку.
При обнаружении же второго маркера, дела обстоят сложнее. Антитела М группы говорят о том, что в организме присутствует острая фаза какого-то заболевания. Однако важно подчеркнуть, что ситуации бывают разные и в таком случае не обойтись без дополнительных исследований.
Говоря о внутриутробных инфекциях, целый ряд из них представляет повышенную опасность, когда речь идет о вероятности инфицирования ребенка. Одним из таких примеров является цитомегаловирус. Появляется такое заболевание на фоне работы герпесных вирусов.
Опасность ЦМВ заключается в том, что инфицирование возможно не только половым путем, но и при тесном контакте в быту и переливании «нечистой» крови. Если женщина впервые столкнулась с герпесом при беременности, то микроорганизм может проникать в плаценту, заражая плод.
В ряде случаев возможны роды ребенка без каких-то аномальных отклонений. Однако у десяти процентов детей присутствуют соответствующие признаки заражения. Проблему представляют и возможные осложнения беременности, среди которых особенно выделяется самопроизвольное ее прерывание, мертворождение, сниженный слух у ребенка, недостаточный вес, воспаление легких, неправильное развитие и слепота в различных ее проявлениях.
Если у инфекционного поражения присутствует сочетание с чем-то еще, более половины детей не доживают и до четырех месяцев. Кроме этого, может фиксироваться на фоне работы инфекции недостаточная скорость развития. Если же поражение имеет легкую локальную форму, то последствия не настолько печальны. Проблема в том, что пока что отсутствуют лекарства, которые способны снимать симптоматику ЦМВ у новорожденных, однако при обнаружении соответствующего диагноза у женщин, ребенка все же оставляют, поскольку присутствует шанс рождения здорового младенца. Будущей матери достаточно пройти курс лечения, который сгладит негативное влияние вируса на организм.
Говоря о герпесе, присутствует и вирус простого герпеса. Если у матери присутствует простой герпес второго типа, то у ребенка проявляется врожденное присутствие одноименной инфекции. В подавляющем количестве случаев столкнуться с такой проблемой можно при половом акте, который не предполагал использования барьерной контрацепции. Ребенок уже с первых месяцев жизни сталкивается с первыми признаками заболевания, а заражается в основном в период прохождения по родовым путям. В ряде случаев вирус может проникать сквозь плаценту.
Присутствие в организме новорожденного герпеса чревато воспалительными процессами в легких, проблемами со зрением, поражениями головного мозга, высыпаниями на коже, высокой температурой, плохой кровяной свертываемостью, желтухой. Порой дети рождаются мертвыми. Если речь идет о тяжелых случаях, ставится диагноз олигофрении, ДЦП и состояния «овоща».
Одним из наиболее опасных в плане значения для эмбриона заболеваний является краснуха. Передается она воздушно-капельным путем, что делает легкой ее для эпидемии. Заражение возможно даже на значительном расстоянии. Серьезная угроза недугом представляется в первом триместре, что приводит к формированию разного рода уродств у ребенка.
Кроме этого, может произойти самопроизвольный аборт или смерть внутри утробы, фиксируются аномалии при сердечномышечном развитии, слуха, зрения. При рождении могут присутствовать различные заболевания, связанные с кожными покровами, воспаление легких, проблемы с головным мозгом и его оболочками.
В списке инфекций повышенной опасности находится и сифилис. Если женщине поставлен соответствующий диагноз и должного лечения не проводится, вероятность ребенка перехватить болезнь доходит до ста процентов. При этом выживаемость не очень высока, менее половины инфицированных детей. При этом у выживших присутствует сифилис с рождения.
Проблема сифилиса заключается в том, что заражение фиксируется даже в случае латентного протекания инфекции. В результате работы инфекционного агента у детей разрушаются зубы, появляются проблемы со зрением и слухом, наблюдаются поражения конечностей, кожных проблем, анемии. В развитии с психической точки зрения такие дети часто отстают от сверстников. При этом могут провоцироваться роды прежде времени и мертворождение.
С опасностью заражения токсоплазмозом сталкиваются владельцы домашних животных. Главные переносчики этой инфекции кошки и собаки. Опасен токсоплазмоз тем, что в половине случаев инфекция проникает сквозь плаценту и инфицирует плод непосредственно. На фоне работы такой инфекции регистрируется поражение зрительных органов, разные цефалии, воспаление головного мозга, у детей присутствуют проблемы с развитием с психомоторной точки зрения. В период, когда планируется беременность, важно, чтобы анализы сдавались обоими родителями.
Еще одна инфекция, представляющая опасность для будущего ребенка – это парвовирус В19. Проблема его заключается в провоцировании инфекционной эритемы. Взрослые при столкновении с такой болезнью не ощущают никакой симптоматики, а вот для плода опасность более чем высока.
Часто на фоне парвовируса В19 регистрируется мертворождение, самопроизвольные аборты и инфицирование внутри утробы. При этом в среднем десять процентов детей не выживают. Особенную опасность инфекция представляет в период с 13 по 28 недели беременности, поскольку в эти моменты у плода отсутствует какая-либо защита.
Инфекция приносит вместе с собой поражения головного мозга, отечность, анемию, гепатит, миокардные воспаления, перитонит. Не менее опасна и ветряная оспа, более известная как ветрянка. Ребенок сталкивается с внутриутробным заражением в четверти случаев, однако симптоматика присутствует не всегда. Врожденная ветрянка может быть диагностирована по мозговым поражениям, воспалению легких, кожной сыпи, задержке развития конечностей и органов зрения, вплоть до атрофии зрительного нерва.
Малыши, которые были инфицированы в утробе, не лечатся от ветрянки, поскольку отсутствует прогрессирование клинической картины. Если беременная столкнулась с инфекцией непосредственно перед родами, то после рождения ребенок лечится иммуноглобулином, поскольку в материнском организме соответствующие антитела отсутствуют.
Нельзя исключать опасность и гепатита В. Такая инфекция очень популярна среди людей, предпочитающих незащищенный секс. Возбудитель заболевания опасен тем, что беспрепятственно проникает сквозь плаценту. Очень опасно подхватить такую инфекцию в период с четвертого по девятый месяц беременности.
В результате заражения, ребенок может приобрести гепатит В, однако он поддается лечению. Спровоцировать может инфекция и печеночные заболевания онкологического спектра, вялотекущую форму гепатита. При острой форме этого заболевания у ребенка может развиваться печеночная недостаточность, что приводит к его гибели. Фиксируется у детей с такой проблемой и задержка в плане развития психомоторных функций, гипоксия. У женщины может попросту случиться выкидыш.
Не стоит забывать и об опасности ВИЧ-инфицирования. При присутствии такой инфекции страдают особые лимфоциты, связанные с иммунной системой. В большинстве случаев получить ВИЧ можно при незащищенном половом акте или использовании одноразовых медицинских предметов многократно. Заражение ребенка происходит как в период утробного развития, так и непосредственно при родах.
Дети, признанные ВИЧ-инфицированными, остаются на интенсивное комплексное лечение. В противном случае смертность до двух лет демонстрирует высокие показатели, поскольку инфекцией быстро поражается слабый организм. Часто дети с таким диагнозом могут скончаться даже от простейших болезней, которые для здоровых детей опасности не представляют.
Чтобы подтвердить присутствие ВИЧ у ребенка, достаточно пройти специальную ПЦР диагностику. Важно обнаружить вирус и у беременной женщины, поскольку заразить здорового ребенка может инфицированное материнское молоко.
Одна из последних проблем – это листериоз. Развивается болезнь как результат жизнедеятельности особой бактерии листерии. Опасность микроорганизма заключается в легком проникновении его через плаценту. Беременная же его может подхватить при употреблении в пищу немытых овощей или зараженных продуктов животного происхождения. Опасность болезни в ее латентном течении, хотя у некоторых признаки заражения все-таки присутствуют.
Присутствие инфекции у ребенка выражается в виде сыпи и большого количества гнойничков. Нельзя исключать воспаление головного мозга, сепсис. При активном листериозе возможно самопроизвольное прерывание беременности или смерть ребенка в утробе. Если признаки очевидны в первую после родов неделю, 60 процентов детей не выживают.
источник
Наши преимущества:
- Недорого прием врача от 900 рублей
- Срочно анализы в день обращения от 20 минут до 1 дня
- Близко 5 минут от метро Варшавская и Чистые пруды
- Удобно работаем каждый день с 9 до 21 каждый день (включая праздники)
- Анонимно!
Внутриутробные инфекции являются фактором, серьезно угрожающим нормальному протеканию беременности и рождению здорового ребенка, а значит, требуют безотлагательного выявления и лечения.
В медицине под внутриутробными инфекциями подразумеваются инфекционные заболевания, которые могут передаваться от женщины плоду во время беременности, а также в процессе родовой деятельности. Зачастую безобидные для матери, они в ряде случаев вызывают значительные проблемы со здоровьем новорожденного. Поэтому их своевременное выявление и излечение являются неотъемлемой составляющей процесса наблюдения пациентки в период вынашивания ребенка.
Полимеразная цепная реакция – высокоточный анализ, суть которого состоит в следующем: сотрудником нашей лаборатории осуществляется забор исследуемого материала (мочи, влагалищных выделений, спинномозговой или амниотической жидкости), который затем обрабатывается специальными ферментами. Их активность в отношении определенных патогенных микроорганизмов и позволяет сделать вывод о наличии того или иного заболевания.
Квалифицированные и опытные врачи-гинекологи нашей клиники при наличии показаний стараются назначать ПЦР при беременности на ранних сроках. В этом случае шанс выявить инфекцию и своевременно вылечить ее раньше, чем болезнь нанесет непоправимый вред плоду, возрастает многократно.
Результаты этого анализа бывают положительными (когда та или иная инфекция выявлена) либо отрицательными (когда возбудители инфекционных заболеваний в организме беременной пациентки не обнаружены).
В единичных случаях могут наблюдаться результаты, которые оказываются ложноположительными или ложноотрицательными. Почти всегда они – следствие нарушений технологии во время забора материала и работы с ним. Поэтому требования к стерильности и профессионализму сотрудников в лаборатории нашего медицинского центра «Частная практика» являются максимально строгими и неукоснительно соблюдаются персоналом. Это позволяет гарантировать высокую точность и достоверность полученных данных.
Проводить анализ ПЦР при беременности в рамках комплексной диагностики возможных внутриутробных инфекций целесообразно для выявления следующих патологий:
- цитомегаловируса;
- простого герпеса – вирусов первого и второго типа;
- токсоплазмоза;
- вирусного гепатита;
- ВИЧ;
- сифилиса;
- микоплазмоза и уреаплазмоза;
- трихомониаза;
- грибковых инфекций (кандидоза);
- патологий, имеющих бактериальную природу (туберкулеза, сальмонеллеза);
- ряда других заболеваний.
В обязательном порядке внеплановая ПЦР-диагностика назначается при подозрении на наличие у пациентки острых и хронических ЗППП, при беременности, протекающей с осложнениями, в частности, если на ранних сроках женщина перенесла краснуху либо ветряную оспу (герпес 3 типа). Эти вирусы чреваты развитием у плода серьезных пороков. Анализ проводится также в тех случаях, когда присутствует хронический воспалительный процесс неясной этиологии в мочеполовой системе.
Врачи-гинекологи нашей медицинской клиники «Частная практика» не только при необходимости всегда назначают ПЦР-анализ, но и знают, как правильно расшифровать его результаты. На основании этой расшифровки наши специалисты назначают комплексное эффективное лечение, которое не навредит ни пациентке, ни плоду и при этом позволит минимизировать риски заражения будущего ребенка опасными инфекциями.
Прием в наших клиниках ежедневно с 9.00 до 21.00
В ЮАО и ЮЗАО – метро Варшавская, Каховская, Севастопольская – ул. Болотниковская дом 5 корп 2, тел. 8-499-317-29-72
В центре (ЦАО) – метро Чистые пруды, Тургеневская, Лубянка – Кривоколенный переулок дом 10 стр 9, тел. 8-495-980-13-16
источник
В период планирования зачатия или при постановке на учет по поводу уже наступившей беременности женщине необходимо пройти ряд лабораторных исследований. Среди них одним из самых важных является анализ на TORCH-инфекции, хотя он не входит в перечень обязательных и назначается по усмотрению врача.
По результатам исследования определяется наличие в крови возбудителей самых опасных для женщины и будущего ребенка инфекций: токсоплазмоза (T), гепатит В, сифилис и другие (O), краснухи (R), цитомегаловируса (С) и вируса простого герпеса (H).
Данное исследование направлено на возможное выявление в организме женщины возбудителей наиболее опасных внутриутробных инфекций и заболеваний, передающихся половым путем. Многие из этих патологий протекают в скрытой форме, то есть женщина может не испытывать никаких симптомов болезни, но является переносчиком вирусов и другой патогенной микрофлоры.
Опасность такого латентного течения заболевания заключается в том, что оно может передаться будущему ребенку, вызвав у него многочисленные нарушения со стороны функционирования различных органов и систем.
Исследование на ТОРЧ-инфекции ставит своей целью выявление наличия у женщины иммунитета к основным патологиям, которые грозят прерыванием беременности или развитием у эмбриона серьезных проблем. Особую опасность такие заболевания представляют в первые 12 недель беременности, поскольку именно в этом периоде происходит закладка основных систем организма плода.
Комплекс исследований, входящих в ТОРЧ-анализ, включает тесты на определение основных инфекционных агентов, являющихся возбудителями серьезных заболеваний. В этот перечень входят:
- Токсоплазмоз. Это заболевание, вызываемое простейшими внутриклеточными микроорганизмами, основными носителями которых являются кошки. Отличительной особенностью патологии является длительный характер протекания. Болезнь может быть как приобретенной, так и врожденной. Токсоплазмоз может спровоцировать развитие таких заболеваний, как гепатит, пневмония, менингоэнцефалит и других.
Воспалительный процесс при проникновении в организм возбудителя может затрагивать центральную нервную систему, органы зрения и слуха, а также инфекция крайне негативно влияет на печень. Во время беременности может произойти внутриутробное заражение плода, последствием которого часто является самопроизвольный аборт.
- Различные заболевания инфекционной природы, которые обозначены в аббревиатуре TORCH буквой О. К этой группе относятся передающиеся половым путем, такие как гонорея и сифилис, а также инфекции, вызванные патогенной микрофлорой – уреаплазмой, хламидиями и другими. Сюда же относятся и вирусные заболевания, например, гепатит, ВИЧ и другие.
- Краснуха. Это заболевание выделено в отдельную группу, которая обозначена буквой R. Болезнь передается воздушно-капельным путем, ее возбудителем является очень опасный вирус, который очень устойчивый к воздействию факторов внешней среды.
- Если женщина переболела краснухой в детстве, у нее вырабатывается стойкий иммунитет к инфекции, и во время вынашивания ребенка никаких негативных последствий перенесенное заболевание на состояние плода не оказывает. Но если вирусная инфекция развивается во время беременности, у плода могут возникнуть патологии, часто несовместимые с жизнью. Обычно женщине, заразившейся краснухой, показано прерывание беременности.
- Цитомегаловирусная инфекция (С). Этот вирус по разным данным присутствует в организме большей половины женщин, не вызывая никаких неприятных симптомов. По сути, болезнь является хронической, но в большинстве случаев она никак не проявляется, а носитель вируса не подозревает о наличии ее у него в организме. При развитии заболевания у пациента увеличиваются клетки печени и других внутренних органов.
Опасность ЦМВИ представляет при первичном заражении беременной женщины, поскольку в этом случае заболевание может передаться эмбриону и нанести ему непоправимый вред. Если результаты анализа на ТОРЧ показали наличие в крови женщины цитомегаловируса, ей обычно рекомендуют прервать беременность.
- Герпес (H). В рамках ТОРЧ-анализа проверяется наличие в организме вирусов простого герпеса ВПГ-1 и ВПГ-2. Эта инфекция обычно поражает слизистые оболочки внутренних органов и ротовой полости, причем вирус ВПГ-2 передается преимущественно при половом акте, но в случае оральных сексуальных контактов он может поражать и слизистую рта.
Если у беременной по результатам анализов обнаружено наличие инфекции в родовых путях, ей показано кесарево сечение при родах, чтобы избежать заражения ребенка.
Объединение всех этих инфекций в одну группу анализов обусловлено однотипностью их симптоматики. В большинстве случаев они напоминают признаки простудных респираторных заболеваний или общего переутомления. Женщины обычно не уделяют должного внимания такому недомоганию и не торопятся обращаться к врачу.
Анализ на ТОРЧ-инфекции проводят либо иммуноферментным методом, либо при помощи ПЦР-диагностики. Результаты, полученные при применении этих методик, могут несколько различаться.
С помощью ИФА возможно выявить антитела к инфекциям, входящим в комплекс ТОРЧ, у плода на ранних стадиях развития. Если получен положительный результат, проводятся дополнительные исследования для определения активности возбудителей заболевания, для этого больше подходят методики ПЦР.
А здесь подробнее о неспецифическом кольпите.
Если женщина со всей ответственностью готовится к рождению ребенка, ей рекомендуется пройти обследование на наличие ТОРЧ-инфекций еще на этапе планирования зачатия. Этот анализ не входит в число обязательных, и гинеколог назначает его только при подозрении на наличие какого-либо заболевания, входящего в этот комплекс.
При наступившей беременности сдавать анализ нужно на сроке до 12 недель. Это связано с тем, что большинство заболеваний из перечня ТОРЧ являются абсолютным показанием для аборта, который без последствий для здоровья женщины можно делать только до конца первого триместра.
Если у женщины есть какие-либо подозрения на наличие у нее возбудителей заболеваний, она может самостоятельно сдать анализ в любой из аккредитованных лабораторий. Обычно эти сомнения основаны на ранее проведенном курсе лечения от венерических заболеваний, имеющихся симптомах герпеса, плохом самочувствии или при наличии каких-либо заболеваний у полового партнера.
Любое заболевание из комплекса ТОРЧ грозит серьезными патологиями для будущего ребенка, поэтому медики настоятельно рекомендуют женщине пройти обследование.
Если какая-либо патология выявлена на этапе планирования беременности, женщине необходимо пройти полный курс лечения от инфекции и сдать перед планируемым зачатием контрольные анализы.
В случае, если анализ на ТОРЧ был сделан в первом триместре беременности, врач принимает решение о необходимости ее прерывания в зависимости от характера заболевания и степени риска опасных последствий для плода. Так, негативное влияние на эмбрион различных заболеваний, входящих в список ТОРЧ, заключается в следующем:
- при краснухе ребенок может родиться с тяжелым пороком сердца, у него может развиться сахарный диабет, серьезные патологии зрения и слуха, он наверняка будет сильно отставать в умственном и физическом развитии;
- при заражении женщины цитамегаловирусом эмбрион практически всегда погибает, а в случае сохранения беременности ребенок рождается с тяжелыми поражениями центральной нервной системы, эпилепсией, детским церебральным параличом;
- при герпесе высока вероятность прерывания беременности, если этого не произошло, у новорожденного может быть диагностировано тяжелое поражение печени, гепатит, патологии со стороны нервной системы.
Признаки ТОРЧ-инфекции у детей
Особую опасность эти заболевания представляют в случае первичного заражения женщины в период беременности, особенно на поздних сроках, когда аборт делать поздно.
Никаких особых правил для сдачи анализа ТОРЧ не существует, это стандартная процедура забора крови из вены. Накануне исследования следует отказаться от употребления в пищу жирных продуктов, а за несколько дней до анализа от любых спиртных напитков. Кровь нужно сдавать натощак, перед анализом рекомендуется не курить.
Результаты анализа будут известны в течение 3 — 5 дней. Это стандартная процедура, и сроки проведения исследования во всех лабораториях примерно одинаковы.
Женщине сложно самостоятельно разобраться в полученной информации, правильно интерпретировать ее может только врач, и от этого будет зависеть возможность сохранения беременности и схема терапевтических мероприятий.
Обычно результаты анализа на ТОРЧ выглядят в виде таблицы, в которой представлен перечень заболеваний, на которые делались тесты на выявление антител igM и igG, а в последней графе выведен положительный или отрицательный ответ на вопрос о наличии возбудителя в крови. Антитела класса M свидетельствуют о начальном этапе развития заболевания, а класса G – о стадии ремиссии или о том, что инфицирование произошло достаточно давно.
По результатам анализа можно определить, было ли инфицирование первичным, или женщина уже была носителем инфекции до беременности. О первичном заражении свидетельствует так называемая сероконверсия, когда после неоднократно проведенных анализов, показавших отрицательный результат, в сыворотке крови обнаруживаются антитела.
Для таких заболеваний, как краснуха, токсоплазмоз и цитомегаловирус, результаты анализа и рекомендации по дальнейшему ведению беременности выглядят следующим образом:
- При отсутствии антител обоих классов можно говорить об отсутствии инфицирования женского организма, в этом случае беременность может протекать без всяких осложнений при соблюдении профилактических мер.
- Отсутствие антител igM при положительном показателе igG свидетельствует о перенесенном в недавнем прошлом инфекционном заболевании.
- При обратных показателях можно говорить о том, что более года назад женщина была инфицирована токсоплазмами, а к краснухе у нее имеется иммунитет. Если показатель igG превышает значение 10 МЕ/мл, то перед планируемым зачатием женщина должна пройти вакцинацию, по другим заболеваниям необходим постоянный контроль за уровнем в крови антител.
- Положительный тест на оба класса антител свидетельствует об острой фазе заражения краснухой или токсоплазмозом. Такие результаты требуют повторного обследования через две недели с проведением дополнительных видов анализов.
Если женщина сдавала анализ на ТОРЧ-комплекс во время планирования беременности, и все показатели были отрицательными, ей рекомендуется за 3 месяца до предполагаемого зачатия сделать прививку против краснухи.
Чтобы не заболеть токсоплазмозом, необходимо соблюдать простые профилактические рекомендации: исключить контакт с уличными кошками, соблюдать правила личной гигиены, осторожность при разделывании мяса, а также избегать блюд со слабой его прожаркой.
А здесь подробнее о скрытых половых инфекциях.
Все болезни, входящие в комплекс ТОРЧ, представляют серьезную опасность для здоровья и жизни будущего ребенка, поэтому женщине следует принять все меры для раннего выявления возможной патологии и сдать все рекомендуемые анализы.
О расшифровке анализа на ТОРЧ-инфекции смотрите в этом видео:
Долго и незаметно существовать могут скрытые половые инфекции, в результате рано или поздно спровоцировать осложнения. Симптомы часто неявные. Поможет выявить ПРЦ их вид, активность, чтобы начать лечение.
О многом по части состояния здоровья может рассказать мазок на флору у женщин. Врач при расшифровке результатов сопоставит их с нормой, определит степень чистоты, в случае отклонений может предположить дисбактериоз, онкологию, по лейкоцитам воспаление. Показатели при беременности отличаются. Подготовка минимальная.
Из-за бактерий или чрезмерного увлечения личной гигиеной может развиться неспецифический кольпит. Причины могут крыться и в незащищенном половом акте. Лечение включает препараты, свечи, которые также назначают при хроническом кольпите. Насколько он опасен?
Если диагностирован сальпингоофорит, лечение антибиотиками является единственно верным. Однако чаще всего схема включает применение нескольких антибиотиков, иммунотерапию. В некоторых случаях поможет только операция.
источник
Внутриутробные инфекции (ВУИ) являются одними из самых значимых болезней в периоде новорожденности, которые оказывают влияние на уровень младенческой заболеваемости, инвалидности и смертности. Многие инфекционные болезни, начавшиеся еще внутриутробно, дают о себе знать на протяжении всей жизни человека. MedAboutMe познакомит вас с ключевыми понятиями, касающимися врожденных инфекций и расскажет о самых распространенных заблуждениях родителей о внутриутробных инфекциях.
Те состояния у плодов и новорожденных детей, которые связаны с развитием воспалительных процессов вследствие поражения различными возбудителями во время беременности или во время родов, называются внутриутробными инфекциями (ВУИ). Другое их название — врожденные инфекции, или же инфекции комплекса TORCH («торч»).
Почему такое название — TORCH? Этот термин образовался от первых латинских букв наиболее распространенных врожденных инфекций. T — токсоплазма (Toxoplasmosis), R — Rubella (краснуха), C — цитомегаловирусная инфекция Сytomegalia), Н —герпетическая инфекция (Herpes). Под буквой «О» прячутся другие инфекции (Оther), их очень много. В перечень «других» инфекций входят вирусные гепатиты, сифилис, хламидиоз, микоплазменная инфекция, грипп, энтеровирусы, стрептококковая инфекция и прочие болезни, вызванные вирусами, бактериями, грибами и простейшими.
Есть другой термин в медицине — внутриутробное инфицирование. Он свидетельствует о том, что к плоду проникли какие-либо вирусы или другие микроорганизмы, но они еще не вызвали развитие заболевания. Какой бывает исход у внутриутробного инфицирования?
- Иммунная система ребенка справится с патогенными микробами, и он не заболеет.
- Все-таки разовьется инфекция с поражением различных тканей и органов.
- Ребенок станет носителем инфекционных возбудителей.
Внутриутробные инфекции до сих пор остаются одной из самых наболевших тем для врачей и родителей маленьких пациентов. Загадок очень много. Многие болезни не протекают с классической клинической картиной, запутывая и докторов, и мам. Отсюда «растут» мифы и домыслы родителей, которые сталкиваются с врожденными инфекциями. Мы поговорим о наиболее распространенных заблуждениях относительно внутриутробных инфекций.
Эта фраза звучит очень часто из родительских уст, для которых диагноз «внутриутробная инфекция» стал настоящим ударом. «Вся беременность протекала хорошо. Ну, подумаешь, простудой переболела. У кого не бывает? Наверное, меня плохо обследовали. Или вообще, это ошибка!» При подробном расспросе мам, что они подразумевают под фразой «обследовались на все», оказывается, что «все» — это обследование на вирус иммунодефицита человека, гепатиты и сифилис, а также трехкратный мазок на флору из влагалища.
Некоторые женщины обследуются при беременности на цитомегаловирусную инфекцию, токсоплазмоз, вирусы герпеса, краснуху. Лишь в немногих больницах эти анализы бесплатные. В большинстве других клиник такие анализы делаются только на коммерческой основе, а кое-где не проводятся вовсе. В итоге, наиболее полное обследование во время беременности проходят далеко не все будущие мамы. Но даже такое обследование нельзя назвать полным. Остаются еще очень много вирусов и других микроорганизмов, которые могут вызвать развитие врожденной инфекции. Их известно более 100!
Еще стоит учитывать тот факт, что заболеть какой-либо из инфекций женщина может и после заключительного обследования на них. Например, последние анализы будущая мама сдавала в 30 недель, и за пару недель до родов она заразилась хламидийной инфекцией.
Зачастую, получив отрицательные результаты анализов на врожденные инфекции, женщина успокаивается и расслабляется, решив, что для ребенка ничего не грозит. Хотя, не все так радужно. Например, отсутствие иммунноглобулинов класса М и G к токсоплазме или цитомегаловирусу, должно, наоборот, настораживать будущую маму. Потому что эти инфекции несут для нее серьезную угрозу, если она с ними встретится впервые, вынашивая малыша.
Напрашивается вывод: все полученные результаты анализов обследования на врожденные инфекции будущей маме не стоит интерпретировать самой. Только грамотный врач объяснит, что действительно хорошо, а чего стоит опасаться.
Действительно, инфекция может проникать к плоду через половые пути матери. Сначала происходит инфицирование околоплодных вод (хориоамнионит), затем заражается малыш. Таким образом, например, происходит заражение ребенка уреаплазменной инфекцией.
В ряде случаев ребенок заражается в родах, проходя по инфицированным половым путям (например, стрептококковой инфекцией или кандидозом).
Однако даже полное здоровье в половой сфере у матери не гарантирует защиту плода от врожденных инфекций. К примеру, цитомегаловирусная или герпетическая инфекция 1 типа передаются воздушно-капельным путем. А к плоду эти вирусы проникают через плаценту с кровотоком матери.
Бывает так, что инфекционный процесс развивается в организме ребенка уже после его появления на свет. Вероятно, что возбудитель проник в его организм незадолго до родов или вовремя них, а клиническая картина развернулась через некоторое время после рождения. На предположения врачей о течении внутриутробной инфекции некоторые родители возмущенно возражают, обвиняя лечебное учреждение в том, что ребенок заразился чем-то в больнице уже после родов.
Да, такое тоже случается. Но это уже не врожденная инфекция, а постнатальная (то есть, возникшая после родов). В ее возникновении часто оказывается виноватой больничная флора. Однако стоит отметить, что больничная флора не вызывает болезней у всех новорожденных. В группе риска ослабленные дети, недоношенные, малыши, родившиеся в асфиксии и др. Чаще всего заражению подвержены дети, находящиеся в отделении реанимации по разным причинам. Ну и конечно, госпитальная флора может вторично наслоиться на уже текущий воспалительный процесс, начавшийся внутриутробно.
Как же разобраться с диагнозом? В случае обнаружения лишь госпитальной флоры при микробиологическом исследовании биологических жидкостей организма и патологического отделяемого в очагах воспаления (кровь, ликвор, мокрота и др.) диагноз ставится в пользу внутрибольничной инфекции. Выявление одного и того же возбудителя и/или антител к нему у матери, и у ребенка позволяет склониться все-таки к внутриутробному заражению малыша.
Выяснить, какой именно возбудитель стал виновником патологических процессов у ребенка, не так-то просто.
- Во-первых, врожденные инфекции зачастую имеют сходную клиническую картину. В число распространенных признаков врожденных инфекций входят: задержка роста и развития плода, пороки развития различной тяжести и малые аномалии развития, водянка плода, сыпь на коже, катаракта, глаукома. Вскоре после родов у ребенка нередко появляется желтуха, лихорадка, неврологические нарушения, симптомы воспаления легких, сердца, глаз и других органов.
- Во-вторых, иногда симптомов бывает немного, или же они совсем скудные.
- В-третьих, диагностика врожденных инфекций очень сложна. Это объясняется тем, что требуется проведение комплекса различных диагностических процедур и повторение их в динамике, чтобы выявить самого возбудителя или антитела против него. Это под силу далеко не всем больницам (ограниченные возможности лаборатории) и родителям (если сдавать все анализы платно).
- В-четвертых, очень часто так и не удается определить виновника болезни, даже проведя максимально полный комплекс диагностических процедур. Это свидетельствует о необходимости поиска новых методов диагностики возбудителей врожденных инфекций.
Нет, это абсолютно не так. Все органы у ребенка закладываются в первом триместре беременности. Особенно опасным считается период с 3 по 8 недели гестации. Заражение какими-либо внутриутробными инфекциями в этом периоде грозит развитием врожденных пороков различной тяжести. Многие из них несовместимы с жизнью, например, анэнцефалия (отсутствие головного мозга), некоторые пороки сердца и др. Нередко беременность спонтанно прерывается в раннем сроке, если имеет место течение инфекционного процесса. Играет роль не только время заражения, но и вид возбудителя, а также путь передачи инфекции.
Заражение ребенка в раннем фетальном периоде (примерно с 10 по 25 неделю) уже не вызовет пороков. Воспаление будет протекать в сформированных органах, оставляя после себя фиброзные и склеротические изменения. Часто это сопровождается плацентарной недостаточностью и задержкой развития плода.
Поражение плода опасными микроорганизмами после 25 недели гестации приводит к воспалительным изменениям отдельных органов и систем (пневмония, гепатит, менингит и др.) или к генерализованному повреждению (сепсис). При этом роды часто начинаются раньше времени, и ребенок рождается уже с признаками течения инфекции. А вот заражение в момент родов может дать о себе знать не сразу, а спустя несколько дней и недель после рождения.
К сожалению, это не так. Чем раньше ребенок столкнулся с опасным возбудителем, тем тяжелее его лечить. Назначение этиотропного лечения (направленного против самого возбудителя) может быть эффективным лишь тогда, когда идет острый воспалительный процесс. В том, случае, когда имеет место формирование пороков развития, фиброзных или склеротических изменений, эта терапия не окажет должного эффекта.
Поэтому у ребенка, перенесшего внутриутробную инфекцию, могут остаться на всю жизнь отдаленные последствия врожденных инфекций. Это могут быть проблемы со зрением, слухом, трудности в обучении, нарушение физического и нервно-психического развития, тяжелые неврологические последствия и хронические болезни внутренних органов. Этим детям требуется длительное симптоматическое лечение и реабилитация.
источник
Каждой будущей маме приходится сдавать анализы на множество инфекций – даже если он чувствует себя совершенно здоровой. Особая тревога возникает у женщины, если обнаружены возбудители какого-либо заболевания. Какую же опасность представляют внутриутробные инфекции (ВУИ) для плода и можно ли их предотвратить?
Внутриутробная инфекция (ВУИ) – инфекция, которая развивается у плода в утробе матери. Источником заражения внутриутробной инфекцией является организм беременной женщины. В этом случае ребенок рождается уже инфицированным или больным. Возможно также заражение ребенка непосредственно в родах, при прохождении через инфицированные родовые пути.
Во время беременности женщина может заболеть любой инфекцией, и каждая из них может оказать неблагоприятное воздействие на плод. Но способность различных микроорганизмов к инфицированию плода и плаценты различна. Большинство из них могут негативно повлиять на плод только при наличии сопутствующих факторов в виде каких-либо заболеваний, неблагоприятных условий жизни, стрессовых ситуаций.
К безусловным возбудителям, особенно часто вызывающим формирование тяжелой патологии плода, относятся инфекции, объединенные в так называемый TORCH-комплекс: То-токсоплазмоз, R-краснуха, С-цитомегаловирус и Н-герпес.
Хламидиоз, микоплазмоз, уреаплазмоз, трихомониаз, гонорея, относящиеся к заболеваниям, передающимся половым путем (ЗППП), не вызывают столь тяжелого поражения плода, как инфекция TORCH-комплекса, но, учитывая их широкое распространение среди женщин детородного возраста, значение этих инфекций также велико.
Значительную опасность для плода представляют также вирусы гепатитов В и С, ВИЧ и сифилис. В настоящее время обследование на все эти инфекции является обязательным для всех беременных.
Для выявления возбудителей ЗППП проводится диагностика с помощью полимеразной цепной реакции (ПЦР), которая выявляет ДНК возбудителей. Для этого на исследование берут соскобы из половых органов.
Кровь исследуют на наличие антител к возбудителям инфекций TORCH-комплекса, ВИЧ, сифилиса и гепатитов В и С.
О том, что беременная инфицирована, скорее всего, доктор сообщит ей по результатам обследования, так как большинство этих заболеваний протекают бессимптомно.
Выявление возбудителя по данным ПЦР (ДНК – исследования) может означать либо носительство, либо наличие заболевания. В зависимости от конкретной инфекции для уточнения диагноза могут использоваться бактериологические посевы и/или анализы крови.
При исследовании анализов крови могут быть обнаружены защитные антитела классов М и G. Если в крови выявлены только антитела класса G, это означает, что инфицирование произошло достаточно давно, возможно, еще до беременности, в организме сформировался иммунитет к данному возбудителю и в настоящий момент заболевание не представляет опасности для матери и плода.
Выявление антител класса М в большинстве случаев указывают на острую фазу заболевания, даже если нет никаких проявлений. Если антитела к возбудителю не обнаружатся, значит, иммунитета к данному заболеванию в организме нет. Однако в каждом конкретном случае возможны варианты, поэтому оценивать результаты анализов должен врач.

Внутриутробная инфекция (ВУИ) может проявляться поражением различных органов и тканей плода: воспалением печени (гепатитом), желудочно-кишечного тракта (гастроэнтеритом), легких (пневмонией), оболочек и вещества головного мозга (менингоэнцефалитом), уха (отитом), слизистой носа (ринитом), кожных покровов (пиодермией) и др. Причем тяжесть заболевания плода и новорожденного значительно более выражена, чем у взрослого человека. Очень высока вероятность проникновения микроорганизмов в кровь с развитием поражения всего организма ребенка.
Наибольшие проблемы возникают при сочетанной инфекции. Известно, что сочетание даже двух инфекций взаимно усиливает их негативное влияние на организм, а также вызывает снижение иммунитета, из-за чего уменьшается эффективность лечения.
Следует также отметить тот факт, что даже при нормальной беременности происходит некоторое угнетение иммунитета, необходимое для вынашивания плода, поэтому именно при беременности можно наблюдать активизацию скрытых инфекционных заболеваний.
При наличии в организме беременной женщины возбудителя какой-либо инфекции чаще всего имеется воспаление влагалища и шейки матки – это доктор может обнаружить при осмотре, но, как уже было сказано, процесс может протекать скрыто, без каких-либо выраженных проявлений.
Если инфекция не будет выявлена на этапе, в дальнейшем возможно ее распространение на слизистую оболочку матки, оболочки плода и плаценту и, далее, инфицирование плода.
При наличии полноценного иммунитета у беременной женщины инфекция может не оказывать влияния на состояние плода, оставаясь локализованной в канале шейки матки и влагалище. В этом случае, однако, сохраняется возможность инфицирования новорожденного при прохождении через родовые пути матери.
Следует отметить, что легкая, возможность даже бессимптомная, инфекция у матери может вызвать развитие тяжелого поражения плаценты и плода, вплоть до его гибели.
Тяжесть заболевания плода и исход беременности напрямую зависят от срока, на котором произошло инфицирование. Чем раньше инфекция распространяется на плод, тем тяжелее его состояние. На ранних сроках беременности (до 10-12 недель) инфицирование плода, как правило. Сопровождается его внутриутробной гибелью и ранним выкидышем.
На более поздних сроках под влиянием инфекции возможно формирование патологии различных органов и систем плода, например гидроцефалии – скопление жидкости в желудочках головного мозга. Если инфицирование произошло перед родами, то заболевание проявляется в первые дни после родов.
Основным проявлением страдания плода во время беременности является развитие плацентарной недостаточности. При этом нарушаются процессы доставки питательных веществ и кислорода, необходимых для роста и развития плода, выработка необходимых для развития и сохранения беременности гормонов, а также процесс выведения токсических веществ; ухудшается и антимикробное действие плаценты.
Для предотвращения внутриутробного инфицирования плода проводится лечение заболевания у беременной женщины. Как правило, это антибактериальные средства, которые назначаются во втором триместре беременности, когда риск неблагоприятного воздействия лекарственных препаратов на плод значительно снижается.
К сожалению, выбор препаратов, разрешенных к использованию при беременности, очень ограничен, поэтому лечение инфекций в условиях беременности представляет определенные трудности.
Помимо лечения основного заболевания проводится профилактика плацентарной недостаточности, т.к. здоровая плацента в большинстве случаев препятствует распространению инфекции к плоду.
С этой целью назначают препараты, улучшающие кровообращение, снижающие тонус матки, метаболические комплексы, улучшающие питание плода.
источник
Внутриутробные инфекции (ВУИ) (синоним: врожденные инфекции) — группа инфекционно-воспалительных заболеваний плода и детей раннего возраста, которые вызываются различными возбудителями, но характеризуются сходными эпидемиологическими параметрами и нередк
Внутриутробные инфекции (ВУИ) (синоним: врожденные инфекции) — группа инфекционно-воспалительных заболеваний плода и детей раннего возраста, которые вызываются различными возбудителями, но характеризуются сходными эпидемиологическими параметрами и нередко имеют однотипные клинические проявления. Врожденные инфекции развиваются в результате внутриутробного (анте- и/или интранатального) инфицирования плода. При этом в подавляющем большинстве случаев источником инфекции для плода является мать. Однако использование инвазивных методов наблюдения за женщинами в период беременности (амниоцентез, пунктирование сосудов пуповины и др.) и внутриматочное введение (через сосуды пуповины) препаратов крови плоду (эритроцитарная масса, плазма, иммуноглобулины) могут привести к ятрогенному инфицированию плода. Истинная частота врожденных инфекций до настоящего времени не установлена, но, по данным ряда авторов, распространенность данной патологии в человеческой популяции может достигать 10%. ВУИ относятся к тяжелым заболеваниям и во многом определяют уровень младенческой смертности. При этом актуальность проблемы ВУИ обусловлена не только существенными пери- и постнатальными потерями, но и тем, что у детей, перенесших тяжелые формы врожденной инфекции, очень часто развиваются серьезные нарушения здоровья, нередко приводящие к инвалидизации и снижению качества жизни в целом. Принимая во внимание широкое распространение и серьезность прогноза, можно сделать вывод, что разработка высокоточных методов ранней диагностики, эффективного лечения и действенной профилактики врожденных инфекций является одной из первоочередных задач современной педиатрии [1, 2, 8, 10–14, 18].
Эпидемиология, этиология, патогенез. Основным источником инфекции при ВУИ, как уже было отмечено, является мать ребенка, от которой возбудитель в анте- и/или интранатальный период проникает в организм плода (вертикальный механизм передачи). При этом вертикальная передача инфекции может быть осуществлена восходящим, трансплацентарным и трансовариальным путями в антенатальный период, а также контактным и аспирационным непосредственно во время родов [1, 10, 18]. Антенатальное инфицирование в большей степени характерно для агентов вирусной природы (вирусы цитомегалии (ЦМВ), краснухи, Коксаки и др.) и внутриклеточных возбудителей (токсоплазма, реже — представители семейства микоплазм). Интранатальная контаминация более характерна для агентов бактериальной природы. При этом спектр потенциальных возбудителей индивидуален и зависит от особенностей микробного пейзажа слизистых родовых путей матери. Наиболее часто в этот период плод инфицируется такими микроорганизмами, как стрептококки (группы В), энтеробактерии, а также вирусы простого герпеса (ВПГ) типов 1 и 2, микоплазмы, уреаплазмы, хламидии и др. [1, 10, 11, 18]. До недавнего времени считалось, что наиболее частыми возбудителями ВУИ являются вирусы ЦМВ, ВПГ типов 1 и 2 и токсоплазмы (Toxoplasma gondii). Однако результаты исследований, проведенных в последнее десятилетие, во многом изменили наши представления как об этиологической структуре ВУИ, так и о частоте внутриутробного инфицирования в целом. Так, показано, что распространенность внутриутробного инфицирования среди новорожденных детей значительно выше, чем считалось ранее, и в ряде случаев может превышать 10%. При этом установлено, что этиология внутриутробного инфицирования представлена более широким спектром микроорганизмов, среди которых, кроме традиционных возбудителей, определенную роль играют энтеровирусы, хламидии (Chlamydia trachomatis), некоторые представители семейства Mycoplasmatacae (Ureaplasma urealyticum, Mycoplasma hominis), а также вирусы гриппа и целый ряд других инфекционных агентов. Результаты наших собственных исследований свидетельствуют о высоком уровне внутриутробного инфицирования (22,6%). При этом наиболее часто мы отмечали внутриутробную трансмиссию Ureaplasma urealyticum, в то время как вертикальное инфицирование ЦМВ выявляли лишь в единичных случаях [3, 5]. Кроме того, в последние годы нами, независимо от C. B. Hall и соавторов (2004), показана возможность внутриутробного инфицирования герпес-вирусами типа 4 (Human Herpes Virus IV (Epstein-Barr virus)) и типа 6 (Human Herpes Virus VI) [3, 5, 17].
Следует особо отметить, что потенциальная угроза внутриутробной трансмиссии инфекционных агентов от матери к ее будущему ребенку существенно возрастает в тех случаях, когда женщина имеет отягощенный соматический, акушерско-гинекологический и инфекционный анамнез. При этом факторами риска внутриутробного инфицирования являются: воспалительные заболевания урогенитального тракта у матери, неблагоприятное течение беременности (тяжелые гестозы, угроза прерывания, патологическое состояние маточно-плацентарного барьера, инфекционные заболевания).
Однако внутриутробное инфицирование не всегда приводит к развитию манифестных форм заболевания и во многом зависит от особенностей состояния плода и новорожденного. Так, риск реализации врожденной инфекции значительно возрастает [1, 3, 5, 8, 10, 18]:
- при недоношенности;
- задержке пренатального развития;
- перинатальном поражении ЦНС;
- патологическом течении интра- и/или раннего неонатального периода.
Помимо этого, прогноз внутриутробной трансмиссии зависит от срока гестации, в котором произошло инфицирование, особенностей возбудителя (патогенных и иммуногенных его свойств), типа материнской инфекции (первичная или вторичная), функционального состояния иммунной системы матери, целостности маточно-плацентарного барьера и др.
Характер повреждений эмбриона и плода, степень выраженности воспалительных изменений, а также особенности клинической симптоматики при врожденных инфекциях зависят от целого ряда факторов: свойств возбудителя, массивности инфицирования, зрелости плода, состояния его защитных систем, особенностей иммунитета матери и др. При этом определяющими факторами считают срок гестационного периода, в котором произошло инфицирование, и характер инфекционного процесса у матери (первичная инфекция или реактивация латентной инфекции). Инфекция называется первичной в том случае, если организм инфицируется данным возбудителем впервые, т. е. развитие инфекционного процесса происходит у ранее серонегативного пациента. Если же инфекционный процесс развивается в результате активизации возбудителя, находившегося до этого в организме в латентном состоянии (реактивация), или из-за повторного инфицирования (реинфекция), то такую инфекцию классифицируют как вторичную.
Установлено, что наиболее часто инфицирование плода и развитие тяжелых вариантов ВУИ отмечаются в тех случаях, когда во время беременности женщина переносит первичную инфекцию.
В тех случаях, когда инфицирование происходит в эмбриональный период, чаще отмечаются самопроизвольные выкидыши или возникают тяжелые, несовместимые с жизнью пороки развития. Проникновение возбудителя в организм плода в ранний фетальный период может приводить к развитию инфекционно-воспалительного процесса, характеризующегося преобладанием альтеративного компонента с формированием в поврежденных органах фиброзно-склеротических деформаций. Инфицирование плода в поздний фетальный период может сопровождаться воспалительным повреждением как отдельных органов и систем (гепатит, кардит, менингит или менингоэнцефалит, хориоретинит, поражение кроветворных органов с развитием тромбоцитопении, анемии и др.), так и генерализованным поражением. В целом при антенатальном инфицировании клинические симптомы заболевания, как правило, проявляются уже при рождении.
В то же время при интранатальном заражении сроки реализации инфекционно-воспалительного процесса могут существенно отодвигаться, в результате чего клиническая манифестация ВУИ может дебютировать не только в первые недели жизни, но даже и в постнеонатальный период [1, 10, 18].
Классификация и клинические проявления. Учитывая тот факт, что эффективное лечение инфекций, в том числе и внутриутробных, возможно только при адекватной этиотропной терапии, на практике наиболее приемлемой следует считать классификацию, построенную по этиологическому принципу. Данный подход нашел отражение в «Международной статистической классификации болезней и проблем, связанных со здоровьем» 10-го пересмотра (МКБ-10), рекомендованной ВОЗ и утвержденной Минздравом России (1994). В соответствии с МКБ-10, врожденные инфекции представлены в классе XVI «Отдельные состояния, возникающие в перинатальном периоде» в блоках Р35–Р39 «Инфекционные болезни, специфичные для перинатального периода». При этом в таких рубриках, как Р36 (Бактериальный сепсис новорожденного), P38 (Омфалит новорожденного с небольшим кровотечением или без него), Р39 (Другие инфекционные болезни, специфичные для перинатального периода), среди представленных нозологических форм врожденные варианты инфекции выделяют в тех случаях, если заболевание манифестирует в течение первых 3 суток жизни. Следует обратить также внимание на наличие разделов, указывающих на возможность постановки диагноза неуточненной вирусной (Р35.9), бактериальной (Р36.9) и паразитарной (Р37.9) ВУИ.
Инфекционные болезни, специфичные для перинатального периода (Р35 — Р39)
- P35 Врожденные вирусные болезни
P35.0 Синдром врожденной краснухи.
P35.1 Врожденная цитомегаловирусная инфекция.
P35.2 Врожденная инфекция, вызванная вирусом простого герпеса [Herpes simplex].
P35.3 Врожденный вирусный гепатит.
P35.8 Другие врожденные вирусные инфекции.
P35.9 Врожденная вирусная болезнь неуточненная. - P36 Бактериальный сепсис новорожденного.
P36.0 Сепсис новорожденного, обусловленный стрептококком группы В.
P36.1 Сепсис новорожденного, обусловленный другими и неуточненными стрептококками.
P36.2 Сепсис новорожденного, обусловленный золотистым стафилококком [Staphylococcus aureus].
P36.3 Сепсис новорожденного, обусловленный другими и неуточненными стафилококками.
P36.4 Сепсис новорожденного, обусловленный кишечной палочкой [Escherichia coli].
P36.5 Сепсис новорожденного, обусловленный анаэробными микроорганизмами.
P36.8 Сепсис новорожденного, обусловленный другими бактериальными агентами.
P36.9 Бактериальный сепсис новорожденного неуточненный. - P37 Другие врожденные инфекционные и паразитарные болезни
P37.0 Врожденный туберкулез.
P37.1 Врожденный токсоплазмоз.
P37.2 Неонатальный (диссеминированный) листериоз.
P37.3 Врожденная малярия, вызванная Plasmodium falciparum.
P37.4 Другая врожденная малярия.
P37.5 Кандидоз новорожденного.
P37.8 Другие уточненные врожденные инфекционные и паразитарные болезни.
P37.9 Врожденная инфекционная или паразитарная болезнь неуточненная. - P38 Омфалит новорожденного с небольшим кровотечением или без него
- P39 Другие инфекционные болезни, специфичные для перинатального периода
P39.0 Неонатальный инфекционный мастит.
P39.1 Конъюнктивит и дакриоцистит у новорожденного.
P39.2 Внутриамниотическая инфекция плода, не классифицированная в других рубриках.
P39.3 Неонатальная инфекция мочевых путей.
P39.4 Неонатальная инфекция кожных покровов.
P39.8 Другая уточненная инфекция, специфичная для перинатального периода.
P39.9 Инфекция, специфичная для перинатального периода, неуточненная.
Установлено, что в подавляющем большинстве случаев ВУИ различной этиологии у новорожденных детей имеют сходные клинические проявления. Наиболее типичными симптомами ВУИ, выявляемыми в раннем неонатальном периоде, являются задержка внутриутробного развития, гепатоспленомегалия, желтуха, экзантемы, дыхательные расстройства, сердечно-сосудистая недостаточность и тяжелые неврологические нарушения, тромбоцитопения. При этом попытки верификации этиологии врожденной инфекции только на основании клинических симптомов, как правило, редко бывают удачными [10, 14, 18]. Учитывая низкую специфичность клинических проявлений врожденных инфекций, в англоязычной литературе для обозначения ВУИ неустановленной этиологии используется термин «TORCH-синдром», включающий первые буквы латинских названий наиболее часто верифицируемых врожденных инфекций: T обозначает токсоплазмоз (Тoxoplasmоsis), R — краснуху (Rubella), С — цитомегалию (Cytomegalia), Н — герпес (Herpes) и О — другие инфекции (Оther), т. е. те, которые также могут передаваться вертикально и приводят к развитию внутриутробных инфекционно-воспалительных процессов (сифилис, листериоз, вирусные гепатиты, хламидиоз, ВИЧ-инфекция, микоплазмоз и др.) [1, 10, 14, 18].
Лабораторная диагностика. Отсутствие специфических симптомов и однотипность клинических проявлений врожденных инфекций обосновывают необходимость своевременного использования специальных лабораторных методов, направленных на достоверную верификацию этиологии ВУИ. При этом обследование новорожденных и детей первых месяцев должно обязательно включать методы, направленные как на непосредственное выявление возбудителя заболевания, его генома или антигенов («прямые»), так и на обнаружение маркеров специфического иммунного ответа («непрямые» методы диагностики). К прямым методам диагностики относятся классические микробиологические методики (вирусологический, бактериологический), а также современные — молекулярно-биологические (полимеразная цепная реакция (ПЦР), ДНК-гибридизация) и иммунофлюоресценция. При помощи непрямых методов диагностики проводят выявление в сыворотке крови ребенка специфических антител к антигенам возбудителя. В последние годы для этого наиболее широко используют иммуноферментный анализ (ИФА). Для того чтобы получить достоверные результаты серологического обследования новорожденных и детей первого месяца жизни и адекватно трактовать эти данные, необходимо соблюдать определенные правила.
- Серологическое обследование должно проводиться до введения препаратов крови (плазмы, иммуноглобулинов и др.).
- Серологическое обследование новорожденных и детей первых месяцев жизни должно проводиться с одновременным серологическим обследованием матерей (для уточнения происхождения: «материнские» или «собственные»).
- Серологическое обследование должно проводиться методом «парных сывороток» с интервалом в 2-3 нед. При этом исследование необходимо выполнять с использованием одной и той же методики в одной и той же лаборатории. Следует особо отметить, что в тех случаях, когда после первоначального серологического обследования ребенку вводились препараты крови (иммуноглобулин, плазма и др.), исследование «парных сывороток» не проводят.
- Оценка результатов серологических исследований должна проводиться с учетом возможных особенностей характера и фазы иммунного ответа.
Особо следует подчеркнуть, что сероконверсия (появление специфических антител у ранее серонегативного пациента или нарастание титров антител в динамике) появляется позже дебюта клинических проявлений инфекции.
Таким образом, при наличии клинико-анамнестических данных, указывающих на вероятность ВУИ у новорожденного ребенка, верификацию заболевания необходимо проводить с использованием комплекса прямых и непрямых методов исследования. При этом идентификация возбудителя может быть проведена любым из доступных методов. В последние годы для детекции возбудителя все чаще используется ПЦР. Материалом при этом может служить любая биологическая среда организма (пуповинная кровь, слюна, моча, смывы трахеи, ротоглотки, мазки с конъюнктивы, из уретры и т. д.). Однако в тех случаях, когда этиология заболевания связана с вирусными агентами, критерием активного периода ВУИ считается обнаружение возбудителя в крови или ликворе (если имеет место поражение ЦНС). В тех случаях, когда геном вируса обнаруживается в клетках других биологических сред, однозначно определить период заболевания очень трудно.
В данном случае необходима параллельная оценка характера специфического иммунного ответа (см. рис. в рубрике «Под стекло»).
При этом для уточнения активности инфекционного процесса показано проведение серологического исследования методом ИФА с количественным определением специфических антител классов IgМ, IgG и оценкой уровня их авидности. Авидность — понятие, характеризующее скорость и прочность связывания антигена с антителом (АТ + АГВ). Авидность является косвенным признаком функциональной активности антител. В острый период развития инфекции сначала образуются специфические IgМ-антитела, а чуть позже — специфические низкоавидные IgG-антитела. Таким образом, их можно считать маркером активного периода заболевания. По мере стихания остроты процесса авидность IgG-антител нарастает, образуются высокоавидные иммуноглобулины, которые практически полностью заменяют синтез IgM. Таким образом, серологическими маркерами острой фазы инфекционного процесса являются IgM и низкоавидные IgG.
Выявление специфических IgM в пуповинной крови, а также в крови ребенка первых недель жизни, является одним из важных критериев диагностики ВУИ. Подтверждением активного периода врожденной инфекции служит также выявление низкоавидных специфических антител IgG с нарастанием их титров в динамике. Следует подчеркнуть, что повторное серологическое исследование должно осуществляться через 2–3 нед («парные сыворотки»). При этом обязательно проводится сопоставление с результатами параллельно проведенного серологического обследования матери.
Особо следует отметить, что изолированное выявление антител класса IgG в сыворотке крови новорожденного без уточнения индекса авидности и без сопоставления с материнскими титрами не позволяет однозначно трактовать полученные данные, так как антитела могут иметь материнское происхождение (поступление в организм плода за счет трансплацентарного их переноса). Только при динамическом (с интервалом в 14–21 день) сравнении уровней специфических IgG-антител новорожденного ребенка и матери можно судить об их природе. Если титры специфических IgG-антител у ребенка при рождении равны материнским, а при повторном обследовании отмечается их снижение, то высока вероятность, что они имеют материнское происхождение.
Совокупность результатов прямых и непрямых методов исследования позволяет установить этиологию заболевания, а также определить его остроту и стадию. В качестве основного способа этиологической верификации инфекционного заболевания в настоящее время используется молекулярно-биологический метод — ПЦР. Многочисленные исследования подтвердили достоверность результатов ПЦР при поиске возбудителей ВУИ. Возможности, заложенные в методе ПЦР, позволяют добиваться максимальной специфичности анализа. Речь идет об отсутствии перекрестных реакций со сходными микроорганизмами, а также о способности выявлять типичные нуклеотидные последовательности конкретного инфекционного агента в присутствии других микроорганизмов. Достоинствами метода ПЦР является возможность раннего обнаружения возбудителя в организме пациента еще до начала формирования иммунного ответа, а также возможность детекции инфекционных агентов при латентных формах инфекционного процесса. Эти преимущества метода ПЦР перед непрямыми способами диагностики инфекционного процесса (ИФА) особенно очевидны у новорожденных детей, что связано со спецификой их иммунной системы. При этом наиболее значимыми являются наличие в сыворотке крови новорожденных материнских антител, переданных трансплацентарно, иммунологическая толерантность и транзиторная незрелость иммунитета. Последнее особенно характерно для недоношенных детей, у которых выраженная незрелость иммунитета обусловливает неадекватность иммунного реагирования. Кроме того, внутриутробное инфицирование плода может создавать предпосылки для развития иммунологической толерантности к этому возбудителю с формированием длительной его персистенции и реактивации в постнатальном периоде. Некоторые авторы указывают также на способность возбудителей TORCH-группы подавлять иммунный ответ [19].
Среди наиболее хорошо изученных ВУИ можно выделить такие заболевания, как краснуха, цитомегаловирусная инфекция (ЦМВИ), герпес-инфекция и токсоплазмоз.
Вирус краснухи относится к семейству Togaviridae, роду Rubivirus. Геном вируса представлен однонитчатой плюс-нитевой РНК. Вирус краснухи относится к факультативным возбудителям медленных вирусных инфекций. Врожденная краснуха — это медленная вирусная инфекция, развивающаяся в результате трансплацентарного заражения плода [1, 8, 9, 18]. Рубеолярная инфекция, перенесенная женщиной в первые месяцы беременности, особенно до 14–16-й нед гестации, приводит к выкидышам, тяжелым поражениям плода, мертворождению, недоношенности и различным нарушениям здоровья в постнатальный период. У детей, родившихся живыми, нередко выявляются тяжелые пороки развития и эмбриофетопатии, приводящие к неблагоприятному исходу уже в неонатальный период. Так, Л. Л. Нисевич (2000) отмечает, что антигены вируса краснухи выявляются у 63% плодов и умерших новорожденных детей с признаками эмбриофетопатий [9]. При этом установлено, что наиболее распространенными клиническими признаками манифестных форм врожденной краснухи у новорожденных являются: врожденный порок сердца (у 75%), недоношенность и/или пренатальная гипотрофия (в 62–66%), гепатоспленомегалия (у 59–66%), тромбоцитопеническая пурпура (у 58%) и поражения органов зрения (у 50–59%). Следует особо отметить, что при манифестных формах заболевания высокий уровень неблагоприятного исхода сохраняется и в постнеонатальном периоде. Так, общая летальность среди этих пациентов на протяжении первых 18 мес жизни достигает 13% [9].
Манифестное течение врожденной краснухи в неонатальный период имеет место только у 15–25% детей с внутриутробным инфицированием. При этом наличие у ребенка врожденных пороков сердца, аномалий органов зрения (катаракта, реже микрофтальмия, глаукома) и нарушений слуха, описанных как триада Грегга, позволяют с высокой долей вероятности предположить, что причиной данных поражений является врожденная рубеолярная инфекция. Однако следует обратить внимание на то, что классическая триада Грегга встречается крайне редко. В большинстве случаев имеет место развитие других — неспецифических клинических проявлений TORCH-синдрома (задержка внутриутробного роста и развития, гепатоспленомегалия, тромбоцитопения, желтуха и др.). Верификация этиологии врожденной инфекции при этом возможна только на основании результатов лабораторного обследования (вирусологические, иммунологические, молекулярно-биологические методы).
Еще более трудная задача — диагностика субклинических форм врожденной краснухи. Следует отметить, что данный вариант течения врожденной рубеолярной инфекции отмечается у подавляющего большинства детей (75–85%).
У новорожденных при этом отсутствует симптоматика TORCH-синдрома, а различные нарушения здоровья проявляются лишь на дальнейших этапах постнатального развития. Проспективное наблюдение за данным контингентом детей позволяет в последующие месяцы и годы жизни выявить серьезные поражения различных органов и систем в 70–90% случаев. Препараты для специфического лечения краснухи не разработаны.
Первоочередной задачей профилактики является защита женщин детородного возраста. При этом краснуха является одной из немногих перинатальных инфекций, которые можно предупредить с помощью плановой вакцинации. Беременные женщины, особенно в ранние сроки беременности, должны избегать контактов с больными краснухой, а также с детьми первого года жизни, у которых при рождении имелись признаки врожденной рубеолярной инфекции.
Возбудитель Cytomegalovirus hominis — ДНК-содержащий вирус семейства Herpesviridae, подсемейства Betaherpesviridae. Согласно классификации, предложенной Международным комитетом по таксономии вирусов (1995), ЦМВ относится к группе «Human Herpesvirus-5». Частота врожденной ЦМВИ колеблется от 0,21 до 3,0% в зависимости от типа исследуемой популяции.
При внутриутробном инфицировании ЦМВ, происходящем на ранних сроках беременности, возможны тератогенные эффекты действия вируса с развитием дис- и гипоплазии органов плода. Однако следует отметить, что по сравнению с другими вирусами (энтеровирусы, вирус краснухи и др.) ЦМВ характеризуется менее выраженным тератогенным эффектом. Врожденная ЦМВИ может протекать в клинической и субклинической формах [1–3, 6, 16, 19–22]. Симптоматические формы ЦМВИ наблюдаются редко и не превышают 10% от общего числа всех случаев внутриутробного инфицирования ЦМВ. Манифестные формы внутриутробной ЦМВИ характеризуются выраженной симптоматикой и тяжелым течением. При этом наиболее часто отмечаются желтуха, гепатоспленомегалия, поражения нервной системы, геморрагический синдром, тромбоцитопения [6, 19, 22]. Тяжелые варианты манифестных форм врожденной ЦМВИ характеризуются высоким уровнем летальности (более 30%) [1, 18]. У выживших детей часто наблюдаются серьезные нарушения здоровья в виде грубой задержки психического развития, нейросенсорная тугоухость, хориоретиниты и т. д. Факторами, обусловливающими неблагоприятный психоневрологический прогноз, являются наличие микроцефалии, хориоретинита, внутричерепных кальцификатов, гидроцефалии. Установлено, что тяжелые формы ЦМВИ развиваются, как правило, в тех случаях, когда мать во время беременности перенесла первичную инфекцию. Значительно реже внутриутробное инфицирование происходит, если мать во время беременности переносит рекуррентную ЦМВИ. Отмечено, что дети с бессимптомной формой внутриутробной ЦМВИ также могут иметь нарушения здоровья. Так, например, K. W. Fowler и соавторы (1999) у 15% детей с бессимптомными вариантами внутриутробной ЦМВИ выявляли нейросенсорную тугоухость [16].
Лечение врожденной ЦМВИ складывается из этиотропной и синдромальной терапии. Показанием к проведению этиотропной терапии врожденной ЦМВИ является активный период клинически манифестной формы заболевания. Критериями активности ЦМВ-инфекционного процесса являются лабораторные маркеры активной репликации вируса (виремия, ДНКемия, АГемия). Серологические маркеры активности ЦМВИ (сероконверсия, анти-ЦМВ-IgM и/или нарастание в динамике концентрации низкоавидных анти-ЦМВ-IgG) менее надежны [6, 10]. Это связано с тем, что результаты серологического обследования нередко оказываются как ложноположительными (например, анти-ЦМВ-IgG, выявленные у ребенка, могут быть материнскими, переданными трансплацентарно и др.), так и ложноотрицательными (например, отсутствие в сыворотке крови ребенка специфических антител к ЦМВ за счет иммунологической толерантности или из-за низкой концентрации антител к ЦМВ (за пределом чувствительности тест-систем) в начальный период иммунного ответа и др.).
Препаратом выбора для этиотропного лечения врожденной ЦМВИ является цитотект. Цитотект — специфический гипериммунный антицитомегаловирусный иммуноглобулин для внутривенного введения. Терапевтическая эффективность цитотекта обусловлена активной нейтрализацией вируса цитомегалии специфическими анти-ЦМВ-антителами класса IgG, содержащимися в препарате, а также активацией процессов антителозависимой цитотоксичности.
Цитотект выпускается в виде 10% раствора, готового к применению. Новорожденным цитотект вводится внутривенно при помощи перфузионного насоса со скоростью не более 5–7 мл/ч. При манифестных формах ЦМВИ цитотект назначается: по 2 мл/кг/сут с введением через 1 день, на курс — 3–5 введений или по 4 мл/кг/сут — введение через каждые 3 дня — в 1-й день терапии, на 5-й и 9-й день терапии. В дальнейшем суточная доза снижается до 2 мл/кг/сут, и в зависимости от клинической симптоматики и активности инфекционного процесса цитотект вводится еще 1–3 раза с тем же интервалом.
Кроме того, в качестве противовирусной и иммуномодулирующей терапии используют рекомбинантный интерферон альфа-2b (виферон и др.). Виферон выпускается в виде ректальных суппозиториев, содержащих 150 000 МЕ интерферон альфа-2b (виферон-1) или 500 000 МЕ интерферон альфа-2b (виферон-2). Способ применения: ректально. Режим дозирования: по 1 свече 2 раза в сутки — ежедневно, в течение 7–10 дней с последующим введением по 1 свече 2 раза в сутки через 1 день в течение 2–3 нед.
Из-за высокой токсичности анти-ЦМВ-препаратов (ганцикловир, фоскарнет натрий) они не применяются для лечения неонатальной ЦМВИ. Вопрос о необходимости этиотропного лечения новорожденных с бессимптомным течением врожденной ЦМВИ окончательно не решен. Целесообразность назначения при этом различных иммуномодуляторов также признается не всеми.
Профилактика врожденной ЦМВИ базируется на выявлении серонегативной прослойки среди женщин детородного возраста. Профилактические меры включают ограничение контакта серонегативных беременных женщин с потенциальными источниками ЦМВИ. Так как наиболее высокий уровень заболеваемости ЦМВИ отмечается у детей раннего и дошкольного возраста, таких женщин не допускают к работе с детьми (в детских садах, школах, больницах и пр.). К уходу за детьми с врожденной ЦМВИ серонегативные беременные также не должны допускаться из-за высокого риска их инфицирования.
Эффективных способов активной специфической иммунопрофилактики ЦМВИ до настоящего времени не разработано.
Термины «врожденный» и «неонатальный» герпес употребляются только применительно к заболеваниям, вызванным ВПГ типов 1 и 2, хотя в настоящее время доказана возможность вертикальной трансмиссии и других представителей семейства Herpesviridae (типы 4 и 6) [3, 15, 17]. Внутриутробный и неонатальный герпес чаще вызывается ВПГ типа 2 (75% всех случаев), хотя оба типа возбудителя могут приводить к формированию схожей патологии плода и новорожденного.
Частота неонатального герпеса существенно отличается в различных регионах и в зависимости от исследуемой популяции составляет от 1,65 до 50 случаев на 100 000 населения. Несмотря на невысокую распространенность неонатального герпеса, он представляет серьезную проблему в связи с повышенным риском развития неблагоприятных исходов. Установлено, что серьезные неврологические осложнения при этом могут возникать в дальнейшем даже при назначении противовирусной терапии. Так же как и в случае ЦМВИ, неонатальная ВПГ-инфекция чаще встречается у детей, матери которых перенесли первичную инфекцию во время беременности. В тех случаях, когда женщина во время беременности переносит рекуррентную герпес-инфекцию риск антенатального инфицирования значительно ниже. Уровень внутриутробного инфицирования при первичном генитальном герпесе у матери в период гестации составляет от 30 до 80%, тогда как при рецидивирующем — не более 3–5%. В то же время установлено, что в тех случаях, когда рецидив генитального герпеса отмечается в конце беременности, а роды происходят естественным путем, риск интранатального инфицирования достигает 50%. Особо следует подчеркнуть, что даже наличие специфических антител при этом не предотвращает развития тяжелых форм заболевания. Так, у 60–80% инфицированных новорожденных при этом развивается герпетический энцефалит. Среди факторов риска развития герпетической инфекции у новорожденного выделяют: первый эпизод материнской инфекции в третьем триместре беременности, инвазивные мероприятия при ведении беременности, роды до 38-й недели гестации, возраст матери до 21 года [1, 18, 24].
Выделяют три клинические формы неонатального герпеса: локализованная форма с поражением кожи, слизистых ротовой полости и глаз; генерализованная форма с полиорганным поражением и герпетическое поражение ЦНС в виде энцефалитов и менингоэнцефалитов (табл.). В тех случаях, когда имела место пренатальная трансмиссия возбудителя, клинические проявления герпетической инфекции могут быть обнаружены уже при рождении. В то же время при интранатальном инфицировании клиническая манифестация возникает не сразу, а через 5–14 дней. При этом локализованные и генерализованные формы неонатального герпеса, как правило, дебютируют в конце первой, реже — в начале второй недели жизни. Наиболее тяжело неонатальный герпес протекает в виде генерализованных форм и особенно неблагоприятно в тех случаях, когда при этом присоединяются герпетические поражения ЦНС. Следует отметить, что в отличие от локализованных форм, при которых всегда имеются типичные кожные или кожно-слизистые проявления герпес-инфекции, генерализованные формы нередко скрываются «под маской» септического процесса, устойчивого к традиционной терапии. Изолированные герпетические поражения ЦНС (менингит, менингоэнцефалит) чаще развиваются на 2–3-й неделях жизни. При этом в клинической картине превалируют неврологические изменения (судорожный синдром, нарушение сознания и т. д.), а при исследовании ликвора выявляют высокий уровень белка и лимфомоноцитарный плеоцитоз.
Следует отметить, что у значительной части детей с генерализованными формами неонатального герпеса, а также при изолированном герпетическом поражении ЦНС кожно-слизистые проявления отмечаются крайне редко, а материнский анамнез у большинства из них не имеет указаний на перенесенную герпетическую инфекцию. В свете вышесказанного становится понятна роль современных диагностических технологий, позволяющих в кратчайшие сроки и с высокой степенью достоверности верифицировать этиологию заболевания.
Герпетическая этиология заболевания подтверждается обнаружением вируса (классический или ускоренный вирусологические методы), его генома (ПЦР) или антигенов методом ИФА в крови, ликворе, моче, содержимом из носоглотки. Обнаружение специфических антител, относящихся к IgM, свидетельствует о наличии герпетической инфекции у новорожденного, однако сроки их появления в сыворотке крови нередко «отстают» от клинических проявлений заболевания.
Лечение. При всех формах неонатальной герпетической инфекции показана специфическая противовирусная терапия ацикловиром, при этом препарат должен вводиться внутривенно. Ацикловир во всех случаях, даже при локализованной форме, вводится внутривенно, так как при этом имеется высокий риск генерализации герпетической инфекции.
При локализованных формах заболевания ацикловир применяют в суточной дозе 45 мг/кг/сут, при генерализованной инфекции и менингоэнцефалите — в дозе 60 мг/кг/сут. Препарат вводится в три приема внутривенной инфузией. Длительность лечения ацикловиром зависит от формы неонатального герпеса: локализованная форма требует проведения терапии в течение 10–14 дней, генерализованная форма и менингоэнцефалит — не менее 21 дня.
Кроме того, для лечения генерализованной формы в комплексную терапию новорожденных могут быть включены стандартные внутривенные иммуноглобулины и иммуноглобулины с высоким титром антител к ВПГ, а также виферон в свечах в дозе 150 000 МЕ 1 раз в сутки в течение 5 дней.
Профилактика. В профилактике неонатального герпеса существенная роль принадлежит раннему выявлению беременных высокого риска, их своевременному и адекватному лечению, а также родоразрешению. При этом необходимо придерживаться следующих рекомендаций [10, 18]:
- при возникновении у женщины первичной герпес-инфекции менее чем за 6 нед до предполагаемых родов ее необходимо готовить к плановому кесареву сечению;
- если первичная герпес-инфекция имела место более чем за 6 нед до родов, то возможно родоразрешение через естественные родовые пути. При этом для снижения риска обострения заболевания к моменту родов целесообразно применение ацикловира с 36-й недели беременности;
- диссеминированная и тяжелая первичная материнская инфекции требуют терапии ацикловиром вне зависимости от срока беременности;
- в тех случаях, когда женщина рожала естественным путем и у нее в этот период был обнаружен генитальный герпес, новорожденному назначается профилактическая терапия ацикловиром и проводится дополнительное обследование на герпетическую инфекцию. При получении отрицательного результата лабораторного обследования и на фоне отсутствия клинических проявлений заболевания противовирусная терапия прекращается.
Врожденная токсоплазменная инфекция. Это инфекционное заболевание, вызываемое внутриклеточным паразитом Toxoplasma gondii, который относится к типу простейших. Основным хозяином возбудителя являются животные семейства кошачьих. В клетках кишечника кошек происходит половое размножение паразита с образованием ооцист, которые после созревания в земле (при благоприятных условиях в теплое время года — около недели) попадают алиментарным путем в кишечник промежуточных хозяев — различных млекопитающих, в том числе человека. По данным серологических исследований, распространенность токсоплазмоза среди населения и животных разных районов мира колеблется в очень широких пределах (5–80%) [7, 10]. Инфицирование и паразитемия у детей и взрослых, включая беременных женщин, в большинстве случаев бессимптомны и только у 10% инфицированных людей отмечается малосимптомная картина заболевания: головная боль, небольшая лихорадка, локальный лимфаденит, легкий миозит. В редких случаях встречаются генерализованная лимфаденопатия, увеличение печени, селезенки, экзантема. Довольно часто отмечающееся поражение глаз (хориоретинит, увеит) связано, по-видимому, с тропизмом возбудителя и особенностями местного иммунитета [18].
Очень тяжелые варианты заболевания (диффузная энцефалопатия, энцефалит, пневмония, миокардит) встречаются только у взрослых с иммунодефицитами (СПИД) и у внутриутробно инфицированных недоношенных детей.
Плод заражается только в случае, если женщина инфицировалась в период беременности [10, 22]. Типичными признаками врожденной инфекции служат хориоретинит, очаги обызвествления в головном мозге, грубая задержка психомоторного развития, гидро- или микроцефалия и судорожный синдром. При этом существует взаимосвязь между тяжестью заболевания у плода и сроком беременности, в котором произошло заражение [7]. При тяжелых формах заболевания плод погибает или рождается преждевременно. Признаки заболевания могут проявляться при рождении или оставаться незаметными в течение многих дней после родов. Клиническая симптоматика может заключаться в задержке внутриутробного развития, генерализованной лимфаденопатии, гепатоспленомегалии, желтухе, гидроцефалии, микрофтальмии и судорогах изолированно или в комбинации. Внутричерепные обызвествления и хориоретинит могут быть обнаружены уже к моменту рождения ребенка, но часто появляются позднее.
По результатам исследований G. Desmonts и J. Couvreur, 63% женщин, заболевших во время беременности токсоплазмозом, родили здоровых детей. Клинические проявления заболевания у большинства новорожденных были минимальными или отсутствовали. Всего лишь у 16% инфицированных новорожденных заболевание было тяжелым, у 20% — средней тяжести, а у 64% — симптоматика отсутствовала. Для подтверждения диагноза используют метод ПЦР, определение антигенов токсоплазмы (Toxoplasma gondii) в крови методом реакции иммунофлюоресценции, а также серологические способы определения титра антител к токсоплазме, индекс авидности этих антител [22].
Лечение. Наиболее эффективны препараты пириметамина (тиндурин, дараприм, хлоридин) в комбинации с сульфаниламидами; препараты блокируют функцию ферментов (редуктазы и синтетазы), участвующих в синтезе фолиевой кислоты паразита. Суточная доза тиндурина — 1 мг/кг (в два приема), сульфаниламидов короткого действия — 0,1 мг/кг (в три-четыре приема).
Оправдала себя схема применения лекарственных средств циклами: 5 дней тиндурин, сульфаниламид — на 2 дня больше (7 дней); проводят три таких цикла с перерывами между ними в 7–14 дней.
По показаниям (хроническая, рецидивирующая форма при иммунодефицитном состоянии, обострении хориоретинита) такой курс терапии повторяют через 1–2 мес.
Противопаразитарный эффект препаратов ко-тримоксазола (бисептол, бактрим и др.) также обусловлен действием на метаболизм фолиевой кислоты возбудителя. Суспензию бисептола, например, назначают детям 3–6 мес по 2,5 мл 2 раза в день, а детям 7 мес – 3 лет — по 2,5–5 мл 2 раза в день в течение 5–7 дней. Кроме того, существует бисептол в таблетках (120 мг), доза которого рассчитывается соответственно возрасту ребенка.
Побочные действия всех антифолатов устраняют назначением фолиевой кислоты, активны и производные фолиевой кислоты; препарат восполняет дефицит фолиевой кислоты больного и способствует восстановлению биосинтеза нуклеиновых кислот. Официальный препарат лейковорин (кальция фолинат) назначают в дозе 1–5 мг в 3 дня (в таблетках 0,005) в течение всего курса терапии.
На втором месте по эффективности стоят макролиды, тормозящие синтез белка на рибосомах возбудителя; учитывают также их меньшую токсичность и действие на внутриклеточные формы паразита.
Спирамицин назначают в два приема в течение 10 дней при массе тела до 10 кг 2 пакетика гранул по 0,375 млн МЕ; рокситромицин (рулид) — 5–8 мг/кг/сут в течение 7–10 дней.
Имеются данные об эффективности клиндамицина (при хориоретините в позднем его проявлении); у детей в возрасте старше 8 лет может быть использован препарат тетрациклинового ряда — доксициклина моногидрат (юнидокс солютаб): в первые 2 сут 4 мг/кг на прием, затем 2 мг/кг 1 раз в день — в течение 7–8 дней. Есть рекомендации, касающиеся применения таких антикокцидийных препаратов, как аминохинол, химикокцид, однако степень их эффективности и побочные действия проверены недостаточно.
Профилактика врожденного токсоплазмоза направлена на выявление групп высокого риска — серонегативных девушек и молодых женщин, с последующим их клинико-серологическим наблюдением до и во время беременности. Кроме того, вопросы профилактики поднимаются при плановой санпросветработе. При этом особое внимание обращается на необходимость соблюдения гигиенических правил (не пробовать сырой мясной фарш при приготовлении блюд, употреблять в пищу только термически обработанное мясо, хорошо вымытые фрукты и овощи, санировать кошачьи испражнения и т. д.). Активная специфическая иммунопрофилактика токсоплазмоза не разработана.
Таким образом, врожденные инфекции по-прежнему остаются одними из наиболее серьезных заболеваний у новорожденных и детей раннего возраста. Разнообразная этиология и однотипность симптомов затрудняют клиническую верификацию ВУИ, чем и определяется необходимость своевременного проведения специальных исследований. При этом целенаправленное обследование на ВУИ должно проводиться у детей из группы риска по внутриутробному инфицированию и реализации врожденной инфекции. К группе риска по внутриутробному инфицированию относят новорожденных, родившихся от матерей с отягощенным урологическим и гинекологическим анамнезом, патологическим течением беременности. В свою очередь, выявление у новорожденных детей таких состояний, как недоношенность, задержка пренатального развития, тяжелое течение интра- и/или раннего неонатального периода, должны рассматриваться в качестве факторов риска реализации ВУИ. В этих случаях показано незамедлительное обследование новорожденных на ВУИ для своевременной верификации этиологии заболевания. Выбор методов обследования новорожденных детей на ВУИ должен основываться на комплексной оценке клинических и лабораторных показателей. При этом для лабораторной диагностики ВУИ оптимальным является сочетание молекулярных (ПЦР) и иммунологических (ИФА) методов диагностики. n
- Врожденные, перинатальные и неонатальные инфекции/Под ред. А. Гриноу, Дж. Осборна, Ш. Сазерленд: Пер. с англ. М.: Медицина, 2000. 288 с.
- Заплатников А. Л. Клинико-патогенетическое обоснование иммунотерапии и иммунопрофилактики инфекционно-воспалительных заболеваний у детей: Автореф. дис. . д-ра мед. наук. М., 2003.
- Заплатников А. Л., Корнева М. Ю., Коровина Н. А. и др. Риск вертикального инфицирования и особенности течения неонатального периода у детей с внутриутробной инфекцией//Рус. мед. журн. 2005. № 13 (1). С. 45-47.
- Ковтун И. Ю., Володин Н. Н., Дегтярев Д. Н. Результаты раннего и отдаленного катамнеза у детей, родившихся от матерей с герпесвирусной инфекцией//Проблемы внутриутробной инфекции плода и новорожденного. М.: ГОУ ВУНМЦ МЗ РФ, 2000. С. 273-275.
- Корнева М. Ю., Коровина Н. А., Заплатников А. Л. и др. Состояние здоровья внутриутробно инфицированных детей//Рос. вестн. перинатол. и педиатрии. 2005. № 2. С. 48-52.
- Коровина Н. А., Заплатников А. Л., Чебуркин А. В., Захарова И. Н. Цитомегаловирусная инфекция у детей раннего возраста (клиника, диагностика, современные возможности терапии): Пособие для врачей. М.: Посад, 1999.
- Лобзин Ю. В., Васильев В. В. Токсоплазмоз у беременных: клинические проявления, терапия и медикаментозная профилактика врожденного токсоплазмоза//Рос. мед. журн. 2001. № 5. C. 40-41.
- Нисевич Л. Л., Талалаев А. Г., Каск Л. Н., Миронюк О. В. и др. Врожденные вирусные инфекции и маловесные дети//Вопросы современной педиатрии. 2002. Т. 1. № 4. C. 9-13.
- Нисевич Л. Л. Современные проблемы диагностики и профилактики врожденной краснухи//Детский доктор. 2000. № 5. С. 26-30.
- Протоколы диагностики, лечения и профилактики внутриутробных инфекций у новорожденных детей/Под ред. Н. Н. Володина. М.: ГОУ ВУНМЦ МЗ РФ, 2002. 100 с.
- Самсыгина Г. А. Современные проблемы внутриутробных инфекций// Педиатрия. 1997. №5. С. 34-35.
- Царегородцев А. Д., Рюмина И. И. Заболеваемость новорожденных внутриутробными инфекциями и задачи по ее снижению в Российской Федерации//Рос. вестн. перинатол. и педиатрии. 2001. Т. 46. № 2. С. 4-7.
- Чебуркин А. В., Чебуркин А. А. Перинатальная инфекция: Пособие для врачей. М., 1999. 49 с.
- Шабалов Н. П. Проблемы классификации внутриутробных инфекций// Педиатрия. 2000. № 1. С. 87-91.
- Lanari M. , Papa I., Venturi V. , Lazzarotto T. et al. Congenital infection with human herpesvirus 6 variant B associated with neonatal seizures and poor neurological outcome// J Med Virol. 2003 Aug; 70(4): 628-632.
- Fowler K. W., Stagno S., Pass R. F. et al. The outcome of congenital cytomegalic virus infection in relation to maternal antibody status//N Engl J Med; 1992; 326: 663-667.
- Hall C. B., Caserta M. T., Schnabel K. C., Boettrich C. et al. Congenital infections with human herpesvirus 6 (HHV6) and human herpesvirus 7 (HHV7)//J Pediatr. 2004 Oct; 145(4): 472-477.
- Infectious Disease of the Fetus and Newborn Infant. Remington J. S., Klein J. O., eds., 5th ed., Philadelphia, PA: WB Saunders Co; 2001: 389-424.
- Istaas A. S., Demmler G. J., Dobbins J. G. et al. Surveillance for congenital cytomegalovirus disease: A Report from the National Cytomegalovirus Disease Registry//Clin Inf Dis. 1995. 20. С. 665-670.
- Liberek A., Rytlewska M., Szlagatys-Sidorkiewicz A. et al. Cytomegalovirus disease in neonates and infants — clinical presentation, diagnostic and therapeutic problems — own experience//Med Sci Monit. 2002; 8 (12): 815-820.
- Noyola D. E., Demmler G. J., Nelson C. T. et al. Early predictors of neurodevelopmental outcome in symptomatic congenital cytomegalovirus infection//J. Pediatr. 2001; 38; 3: 325-331.
- Numazaki K., Fujikawa T., Asanuma H. Immunological evaluation and clinical aspects of children with congenital cytomegalovirus infection//Congenit Anom (Kyoto). 2002 Sep; 42(3): 181-186.
- Remington J. S., Thulliez P., Montoya J. G. Recent Developments for Diagnosis of Toxoplasmosis//Journal of Clinical Microbiology. 2004; 42; 3: 941-945.
- Whitley R. Neonatal herpes simplex virus infection//Curr Opin Infect Dis. 2004 Jun; 17(3): 243-246.
А. Л. Заплатников, доктор медицинских наук, профессор
Н. А. Коровина, доктор медицинских наук, профессор
М. Ю. Корнева
А. В. Чебуркин, кандидат медицинских наук, доцент
РМАПО, Москва
источник