ДНК ПЦР анализы направлены на выявление патогенных микроорганизмов. Они бывают количественные и качественные.
Если при ПЦР ДНК обнаружена или не выявлена, это качественный тест.
Если указывается ещё и концентрация, это количественная ПЦР. Данный анализ более информативен. Хотя требуется он далеко не всегда.
- Когда необходим количественный ПЦР анализ
- ПЦР на микоплазмы, уреаплазмы, гарднереллу, кандиду
- Мазок ПЦР количественный на хламидии
- Количественный ПЦР анализ ВПЧ 21 тип
- Количественное определение РНК ВИЧ и необходимость для лечения
- Оценка результативности лечения с помощью ПЦР анализа крови к гепатитам
- Интерпретация количественной ПЦР мазков и крови
- Подготовка к количественному анализу ПЦР мазков и крови
- К какому врачу обратиться для ПЦР анализа
При ПЦР количественное определение требуется во многих случаях. Она дает дополнительные возможности, если сравнивать с качественным анализом.
Если после проведения ПЦР ДНК обнаружено, знать количество микроорганизмов необходимо, чтобы понять:
- требуется ли пациенту лечение (при низких количественных показателях оно может не назначаться);
- насколько быстро идет выздоровление (есть ли вирусологический ответ от лечения);
- стоит ли продолжать терапию этими же препаратами или нужно менять схему;
- болезнь находится под контролем или возникает рецидив, требующий дополнительных терапевтических мероприятий;
- насколько высоким является риск осложнений (например, вероятность диспластических изменений в шейке матки при папилломавирусной инфекции).
Поговорим подробнее, при каких патологиях могут потребоваться количественные ДНК ПЦР анализы.
Существуют микроорганизмы, которые не всегда вызывают патологический процесс в структурах урогенитального тракта. Они могут вызывать воспалительные или другие симптомы только в том случае, когда популяция бактерий значительно увеличится.
Чтобы узнать, увеличилась она или нет, требуются соответствующие анализы. Многие лаборатории предлагают комплексный количественный анализ ПЦР сразу на несколько возбудителей.
Микоплазмы двух видов могут вызывать воспалительные процессы во влагалище. Это микоплазма гениталиум и хоминис. Причем, гениталиум может вызывать воспаление даже в минимальных концентрациях. Этот микроорганизм рассматривается как однозначно патогенный. При его выявлении даже в малых количествах проводится лечение. Целью его считается эрадикация возбудителя. Критерием успешности терапии является отрицательный анализ ПЦР на микоплазму гениталиум.
А вот хоминис – менее опасный вид данных микроорганизмов. Он может обнаруживаться в урогенитальном тракте многих людей.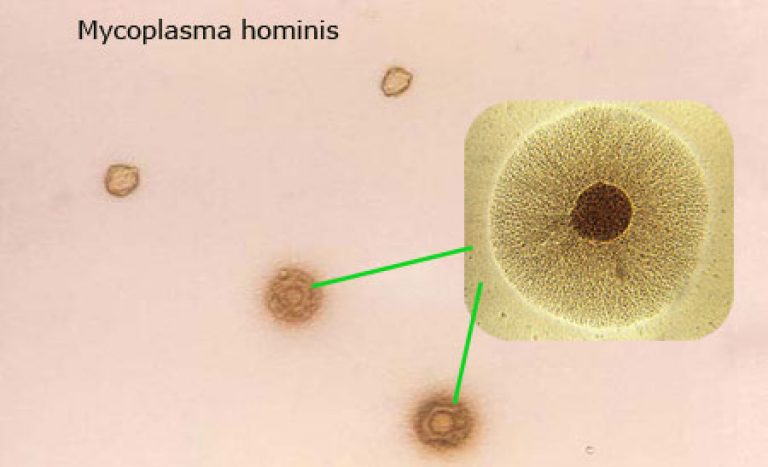
Если ПЦР покажет, что бактерий меньше, лечение может и не назначаться. Но если количество патогенов превышает указанное значение, требуется антибактериальная терапия.
Потому что в больших количествах микоплазмы:
- вызывают воспаление;
- могут провоцировать осложнения;
- передаются при половом акте;
- опасны для беременных.
Гарднереллы – вид транзитных микроорганизмов, которые часто выявляются в урогенитальном тракте женщин. Они не вызывают воспаления. Но в больших количествах провоцируют дисбактериоз. Это заболевание, основным проявлением которого является обильное отделяемое из влагалища с неприятным запахом.
Патология нарушает качество половой жизни. Гарднереллы в больших количествах способны быстро уничтожать лактобактерий. Они вытесняют их. В итоге может оказаться так, что лактобактерии вообще не обнаруживаются во влагалище. Этого не должно случиться, потому что молочнокислые бактерии защищают организм женщины от других микробов. Они делают это за счет продукции молочной кислоты.
Кислая рН влагалища не дает условно-патогенным бактериям чрезмерно развиваться.
Количественная ПЦР ДНК диагностика на гарднереллы показывает, сколько этих микроорганизмов содержится во влагалище. Если их больше 10 4 копий ДНК в мл, требуется антибактериальное лечение. Оно позволяет предотвратить дисбактериоз влагалища или устранить его основные проявления, если они уже присутствуют.
Кандиды – ещё одна группа микроорганизмов, для которых имеет значение количество. Это грибы, которые в норме присутствуют в урогенитальном тракте большинства людей.
Кандидоз является оппортунистической инфекцией. Он развивается, когда в организме ослаблен иммунитет. В этом случае количество кандид резко увеличивается. Появляются красные пятна, белые выделения и другие симптомы, иногда достаточно сильно выраженные.
Само по себе обнаружение кандиды с помощью ПЦР не дает врачу никакой ценной информации. Всем и так понятно, что эти грибы в структурах урогенитального тракта есть. Поэтому качественная ПЦР на кандидоз не проводится.
Клиническое значение имеет только количественный метод ПЦР. При определении кандид в количестве, превышающем пороговое значение, устанавливается диагноз кандидоз. Назначается соответствующее лечение.
Показанием для назначения количественного ПЦР на кандиды является в основном наличие симптомов кандидоза. Анализ также может быть использован в случае обнаружения псевдомицелия при микроскопии мазка из урогенитального тракта. ПЦР позволяет установить вид гриба.
Ведь кандидоз может быть вызван десятками видов микроорганизмов. Чаще всего это кандида альбиканс. Но есть ещё 5-6 видов грибов, которые провоцируют кандидоз достаточно часто. Причем, их наличие усложняет процесс лечения.
Часто такие кандидозы рецидивируют. Они плохо реагируют на традиционно используемые при кандидозе противогрибковые препараты.
Количественная ПЦР на кандидоз используется и после лечения. Она помогает врачу понять, была ли проведенная терапия успешной, и оценить риск рецидива грибкового заболевания в будущем.
Количественная ПЦР на уреаплазмоз тоже проводится достаточно часто. Уреаплазмы рассматриваются как условно-патогенная флора. То есть, они опасны только в больших количествах.
ПЦР количественная на уреаплазмы позволяет решить вопрос о необходимости лечения.
У многих врачей-венерологов целесообразность использования количественной ПЦР на уреаплазмы вызывает вопросы. Этот микроорганизм обладает очень высокой адгезивной способностью. Он крепко прилипает к клеткам, поэтому в клиническом материале может быть гораздо меньше бактерий, чем есть в организме.
Соответственно, количественные показатели могут быть заниженными. Кроме того, они значительно варьируют от анализа к анализу.
Хотя в настоящее время считается, что лечение стоит начинать только при концентрации бактерий от 10 4 копий ДНК в мл, нередко врачи назначают лечение и при меньшем их количестве. Особенно если женщина готовится к беременности.
Есть немало исследований, которые подтверждают: уреаплазма очень опасна для плода. Она вызывает инфицирование околоплодных оболочек.
Уреаплазма способна спровоцировать преждевременные роды. Она вызывает респираторные инфекции у новорожденного плода. Поэтому даже если качественная ПЦР показывает небольшие количества уреаплазм, желательно пролечиться тем женщинам, которые готовятся к беременности.
Не требуется лечение при сочетании таких факторов:
- концентрация уреаплазм ниже пороговой;
- нет симптомов воспаления;
- супружеская пара не планирует беременность.
Тогда лечиться не обязательно. Но такие случаи встречаются редко. Потому что пациенты редко приходят на диагностику венерических заболеваний с профилактической целью. В основном они обращаются после возникновения воспалительных симптомов.
На хламидии чаще проводят тест качественный, а не количественный.
Потому что этот микроорганизм является патогенным.
Одного только факта его обнаружения достаточно, чтобы начать лечение.
Причем, количество копий ДНК не играет существенной роли в определении схемы терапии и дозировок препаратов.
Тем не менее, количественные тесты иногда проводят.
Они дают врачу возможность оценить прогноз заболевания.
Понять, насколько высока вероятность осложнений.
А также спрогнозировать ответ на лечение.
При большой концентрации хламидий в урогенитальном тракте доктор может увеличить курс терапии.
Оценивая данный показатель в динамике, он может понять, работают ли те антибактериальные препараты, которые он назначил.
Такие исследования могут использоваться в диагностике папилломавирусной инфекции.
Почему нужны именно количественные анализы, а не качественные? Они более информативны в плане оценки прогноза заболевания, целесообразности противовирусного лечения и оценки его результативности.
Для первичной диагностики обычно проводят качественную ПЦР. Она помогает установить, какие типы ВПЧ присутствуют в организме. Это могут быть высокоонкогенные, среднеонкогенные или низкоонкогенные типы.
Особую настороженность вызывают вирусы высокой онкогенности. Поэтому не лишним будет знать, в каком количестве они содержатся в урогенитальном тракте.
Особенно важен данный анализ для женщин. Ведь у них ВПЧ является основной причиной рака шейки матки.
В свою очередь карцинома шейки матки – самое частое злокачественное онкологическое заболевание среди молодых женщин.
Проведение количественной ПЦР позволяет установить, прогрессирует или регрессирует патологический процесс. Если количество вирусов увеличивается, это говорит о высоком риске дисплазии шейки матки. А она в дальнейшем переходит в рак.
При длительно сохраняющиеся высокой вирусной нагрузке показано лечение с помощью иммуномодуляторов и противовирусных препаратов общего действия. В процессе лечения проводятся повторные исследования ПЦР.
Врач смотрит, стало вирусов в организме больше или меньше. Если их стало меньше, это хороший прогностический признак. Если же вирусов стало больше, то по результатам количественной ПЦР схему терапии стоит пересмотреть.
Количественная ПЦР имеет важнейшее значение в диагностике и терапии ВИЧ.
В основном первичная диагностика заболевания проводится путем определения уровня антител в крови. Это метод намного дешевле, а результаты можно получить быстрее.
Но в некоторых случаях без ПЦР не обойтись. Метод позволяет обнаружить ДНК провируса или РНК вируса в крови.
В основном используют количественную ПЦР для выявления РНК. Это самый ранний маркер ВИЧ. Анализ крови позволит диагностировать болезнь уже через несколько недель после заражения. А количественная оценка методом ПЦР имеет огромное значение в определении схемы терапии.
С помощью анализа оценивают эффективность лечения. Если вирусная нагрузка снижается до неопределяемой, это говорит о том, что терапия проходит успешно.
Антиретровирусные препараты работают. Но если она начинает возрастать, это свидетельствует о формировании резистентности к препаратам. Подобное нередко происходит через несколько лет после начала лечения.
В таком случае схему лечения приходится менять. Иначе количество иммунных клеток в крови начнет снижаться. Вследствие ухудшения иммунитета начнут присоединяться инфекции и возникать злокачественные новообразования.
Используется также выявление ДНК ВИЧ при помощи ПЦР. Метод более предпочтителен для обследования новорожденных детей. Потому что количество РНК в крови может уменьшаться, если мать получала антиретровирусную терапию. В результате в первые дни жизни ПЦР количественная на РНК вируса может быть ложноотрицательной.
Количественный анализ ПЦР используется при гепатите C для определения уровня виремии.
Метод дает возможность подобрать оптимальную схему терапии. А также он дает возможность оценить, насколько эффективной является проводимая терапия.
Благодаря ПЦР вирус гепатита С определяется уже через 1 неделю с момента заражения. В дальнейшем метод применяется, чтобы понять, было ли специфическое лечение эффективным.
Результаты оцениваются по ряду критериев:
- вирусологический;
- биохимический;
- морфологический.
Вирусологический контроль проводится при помощи ПЦР. Если РНК вируса гепатита С не выявляется, то терапия прошла успешно.
Если результаты остаются отрицательными в течение 6 месяцев, такой вирусологический ответ считается устойчивым.
Появление РНК вируса на фоне прекращения лечения говорит о рецидиве заболевания. В процессе проведения терапии с помощью количественного ПЦР оценивают динамику изменения концентрации вируса.
Оптимальным результатом считается исчезновение РНК в течение не более чем 4 недель противовирусного лечения. Такой вирусологический ответ называют ранним.
ПЦР также позволяет определить тип вируса гепатита. При разных типах назначаются разные схемы лечения. Количественные показатели при вирусном гепатите С оценивают через каждые 3 месяца терапии.
Интерпретацией результатов занимается врач.
Единицей измерения количества патогенных микроорганизмов является концентрация ДНК или РНК в одном миллилитре клинического материала. Она обычно обозначается в 10, которая возведена в степень. Эта степень фактически означает количество нулей, которые следуют после единицы. Например, 10 4 – это 10 000 копий ДНК.
Для разных инфекций нормы отличаются. В каждом случае требуется индивидуальная расшифровка анализа, так как часто их ещё нужно сравнивать с проведенными ранее исследованиями.
Подготовки к сдаче крови не требуется.
А вот к сдаче мазка нужно приготовиться. Есть несколько ограничений, которых следует придерживаться.
Запрещено накануне сдачи анализа:
- вести интимную жизнь – в течение 2 дней;
- принимать антибактериальные препараты (за исключением случаев, когда они назначены врачом) – в течение 2 недель;
- не мочиться – 3 часа;
- женщинам – не спринцеваться и не пользоваться тампонами – 2 дня.
Чтобы сделать качественную ПЦР, обратитесь к доктору-венерологу. Специалисты данного профиля ведут прием в нашем медицинском центре. Они оценят, есть ли у вас показания к назначению данного анализа.
При необходимости вы сможете сдать кровь или мазки в день обращения. Результаты для большинства исследований получите на следующий день.
Для сдачи анализов методом ПЦР обращайтесь к автору этой статьи – венерологу в Москве с многолетним опытом работы.
- ВИЧ
- Гарднереллез
- Кондиломатоз
- Молочница
- Сифилис
- Трихомониаз
- Баланопостит
- Герпес
- Гонорея
- Микоплазмоз
- Уреаплазмоз
- Уретрит
- Хламидиоз
- ЗППП
источник
ПЦР, или полимеразная цепная реакция, является сложным лабораторным методом, который широко используется в медицине и других научных отраслях. ПЦР-диагностика в свое время стала настоящим прорывом в науке.
Количественная ПЦР – это такая разновидность ПЦР, которая проводится в режиме реального времени.
Под этим понимается вариант ПЦР, при котором постоянно регистрируется кинетика реакции, позволяющая качественно оценивать в сложной молекулярной смеси содержание конкретных нуклеотидных последовательностей ДНК.
Количественный метод ПЦР рассмотрим подробнее ниже.
Для диагностики инфекций особенно часто применяются культуральные и серологические методы. Под первым определяются антитела к инфекционному возбудителю в сыворотке крови. При втором биологический материал, взятый от больного человека, применяют для засевания специфической среды, которая благоприятна для роста колоний возбудителя. Диагностика и в том, и в другом случае может длиться дни или недели.
Обследование ПЦР может проводиться с разными биологическими материалами, которые получают от больного человека. В виде образцов выступают кровь и прочие патологические, физиологические и биологические среды и жидкости. Можно сделать ПЦР кала или мочи.
Методом количественной ПЦР чаще всего диагностируют атипичные и вирусные инфекции, поскольку они могут не поддаваться простой диагностике из-за специфики спровоцированного ими патологического процесса. Для определения таких инфекций нужно время, на протяжении которого в организме начинают вырабатываться антитела, определяемые серологическими методами. Но это неприемлемо в ряде случаев.
Способ проведения ПЦР – лабораторное установление инфекции в образцах, изолированных от пациента (ин витро).
Чтобы провести полимеразную цепную реакцию, требуется набор особых реактивов.
Исследуемый материал вносится в пробирки с реактивами. Пробирки ставят в специальный аппарат – амплификатор ПЦР, который предназначен для амплификации (повышения количества) искомых фрагментов РНК или ДНК, ПЦР амплификатор работает в циклическом режиме. При любом цикле, если в образцах имеется последовательность РНК или ДНК возбудителя, то в растворе все больше накапливаются копии частиц данных нуклеиновых кислот. Определить можно и присутствие возбудителя, и количество его в образцах.
Качественный анализ методом ПЦР позволяет получить такой результат:
- отрицательно, когда искомый возбудитель не обнаружен в образцах;
- положительно, если в образцах найдены последовательности, которые характерны для определенного возбудителя.
При положительном результате ПЦР можно говорить с 95%-ной точностью о наличии диагностируемой инфекции. При этом точность наборов ПЦР, применяемых диагностической целью, доходит до 100%.
Обычно 5% неправильных результатов определяются человеческим фактором. Например, нарушения техники проведения анализа и правил хранения реактивов могут в значительной степени уменьшить точность исследования.
Количественная ПЦР определяет понятие вирусной нагрузки. Можно определить при этом, сколько в образцах, взятых у пациента, было комплектов ДНК возбудителя.
Тяжесть инфекции прямо пропорциональна повышению их количества. Также можно определить успешность терапии по уменьшению вирусной нагрузки.
Сдача количественной ПЦР проводится в клинике, преимущественно с утра. Пациенту во время визита к врачу скажут, что необходимо сдавать: соскоб, мазов, мочу или кровь. ПЦР может определить возбудителей вне зависимости от уровня загрязнения материала.
Для положительного анализа в теории требуется присутствие всего лишь одного возбудителя в образцах. На практике же стараются создать еще более благоприятные условия. Существуют для этого некоторые рекомендации:
- если сдают соскоб или мазок из половых органов, нужно воздержаться от интимной связи за три дня до исследования;
- нельзя перед анализом спринцеваться с антибактериальными препаратами или подмываться;
- за три часа до взятия из уретры мазка нужно потерпеть и не опорожнять кишечник.
При сдаче крови пациентом таких правил можно не придерживаться.
Как расшифровываются результаты количественного анализа ПЦР?
В ряде клинических ситуаций появляется проблема эффективности проводимого лечения и/или динамики процесса патологии. Такие вопросы особенно актуальны при обследовании людей с хроническими инфекциями (вирус человеческого иммунодефицита, гепатиты В и С). При диагностике основываются на том, что накопление ампликонов (ПЦР продуктов) пропорционально наличию копий искомого гена в анализируемой пробе.
Конечно, учет результатов проведения количественной ПЦР делается посредством гель-электрофореза с исследованием интенсивность специальных сигналов ПЦР. Также обязательным условием верной количественной оценки полученных результатов являются положительные надежные контрольные пробы, содержащие известное количество копий искомого гена (к примеру, на одну ПЦР-реакцию тысяча копий гена гепатита С). Несколько последовательных разведений количественного контроля позволяет создать калибровочные кривые, и по ним оценивается содержание в клинических образцах генокопий.
В определении количественной ПЦР ключевым достижением стало создание флуоресцентных ДНК-зондов, добавляющихся в реакционную смесь одновременно с простыми праймерами и позволяют отслеживать во времени процесс ПЦР, то есть real-time-ПЦР.
Под методологией TaqMan понимается синтез флуоресцентных ДНК-зондов, которые специфичны к средней части ампликона и имеют две метки на концах. Одной из них является флуоресцентная метка, вторая – молекула-гаситель данной флуоресценции.
Особый прибор, представляющий собой гибрид флуориметра и термоблока-амплификатора, производит постоянные замеры в каждой пробирке флуоресценции (принцип real-time-ПЦР). После 20-40 циклов ПЦР в результате для каждого образца будут получены индивидуальные кривые. Количество копий искомого гена, который содержится в исследуемом образце, может быть вычислено по калибровочным кривым с контрольными образцами.
Также важной особенностью осуществления ПЦР флуоресцентным методом является то, что пробирки со смесью ПЦР нет необходимости открывать при учете результатов. За счет этого снижается возможность заражения продуктами амплификации помещений, и необходимость в выделении особых рабочих областей для проведения электрофореза отпадает.
Что показывает расшифровка количественной ПЦР?
Посредством такого метода, как количественная ПЦР, находят качественные изменения в генах: вставки, делеции и точковые мутации. Но при некоторых наследственных нарушениях соответствующие симптомы появляются в ответ на изменение содержания определенных генов.
Благодаря количественному анализу получают числовой результат, чаще всего в МЕ/мл. Это значит, что в одном миллилитре исследуемого образца найдено определенное количество копий РНК или ДНК возбудителя, измеряемое в международных единицах.
В зависимости от величины диагностируется тяжесть инфекции. Для установления вирусной нагрузки обычно исследуют кровь, поскольку вирусы при заболевании свободно двигаются в крови.
Количественная ПЦР в анализе крови обладает двумя особенностями.
- Анализ проводится в присутствии праймеров или дезоксирибонуклеозидтрифосфатов, которые мечены посредством флуоресцентной или радиоактивной метки для точного определения содержания сформировавшегося продукта ПЦР.
- В процессе ПЦР следует рано завершать реакцию, пока не появилось слишком много продуктов ПЦР. Связано это с тем, что на конечной стадии насыщения, когда становится очень много продуктов ПЦР, лимитирующими звеньями данной реакции выступают как сам фермент, так и субстраты. Окончание очередного цикла ПЦР в таких условиях уже не характеризуется удвоением количества продуктов ПЦР, нивелируются незначительные количественные отличия между различными пробами, довольно четко определяемыми на ранних этапах после прохождения ряда циклов реакции.
ПЦР-исследование имеет стоимость, которая зависит от того, какая именно инфекция будет проверена, от методики анализа и исследуемого материала. Чтобы определить одну инфекцию, придется отдать в пределах 200-800 рублей. Также добавляется плата за взятие биоматериала – примерно 400 рублей.
источник
ПЦР – важнейший метод диагностики инфекционных заболеваний.
Сегодня большинство лабораторий делают анализы на ИППП и другие инфекционные патологии при помощи реакции амплификации нуклеиновых кислот. Она очень точная, позволяет диагностировать болезнь даже на начальных стадиях.
Для диагностики туберкулеза все чаще применяют именно ПЦР. Ранее болезнь можно было выявить только с помощью микроскопии или посева мокроты. Используется также ИФА для определения антител в крови. Но все эти способы менее чувствительны. Они помогают подтвердить диагноз только при наличии большого количества бактерий.
ПЦР обнаруживает туберкулез даже в доклинической стадии. В том числе в случаях, когда культуральное исследование дает ложноотрицательные результаты. Исследовать можно любой клинический материал. Это может быть мокрота, кровь, спинномозговая жидкость, смывы бронхов, менструальная кровь и т.д., в зависимости от предполагаемой локализации инфекции.
Анализ на гепатит Ц, если он качественный, может быть положительным или отрицательным. В ходе исследования обнаруживается РНК вируса. Это один из основных маркеров гепатита.
В ходе диагностики могут быть использованы тест-системы с разной чувствительностью. Тесты бывают малочувствительные и высокочувствительные.
Первые обходятся значительно дешевле. В этом их основное преимущество. Но в то же время они выявляют вирус лишь в концентрации от 50 МЕ/мл и более. То есть, не исключены ложноотрицательные результаты.
По рекомендации ВОЗ, диагноз гепатит С может быть установлен, если три раза проведенное исследование ПЦР обнаружило РНК вируса. Это один из наиболее ранних методов диагностики.
ПЦР становится положительной, даже когда антитела ещё не появляются. РНК в крови может быть обнаружена уже через 1-2 недели после заражения.
Существуют также высокочувствительные тесты. Таковыми считаются те, что определяют РНК при концентрации 25 МЕ/мл или меньше. Такие диагностические тесты обходятся дороже низкочувствительных в несколько раз. Но иногда необходимость в их проведении все же возникает.
Основные случаи, когда высокочувствительный тест ПЦР необходим:
- Антитела положительные, но РНК в крови не обнаруживается.
Наличие одних только антител не дает оснований установить диагноз. Потому что антитела могут говорить и о перенесенной в прошлом инфекции. Требуется подтверждения путем выявления РНК. И если концентрация её низкая, обычный тест ПЦР может дать отрицательный результат. В таком случае проводят высокочувствительный тест. Он позволяет с высокой достоверностью либо подтвердить, либо исключить диагноз.
- Наличие признаков поражения печени.
Если анализ на антитела отрицательный, а признаки поражения печени присутствуют, врач может назначить высокочувствительный тест ПЦР на гепатит С. Потому что отрицательные антитела не говорят о том, что болезни нет. Вполне вероятно, что инфицирование состоялось недавно, и АТ ещё не успели синтезироваться. Кроме того, их может не быть при иммунодефиците человека или в случае лечения иммунодепрессантами.
- Оценка эффективности терапии.
Согласно европейских рекомендаций 2015 года, для оценки вирусологического ответа на терапию должны использоваться только высокочувствительные тесты ПЦР. Данный метод диагностики используется также для выявления гепатита В. В ходе диагностики определяется фрагмент ДНК. Это самый ранний тест, позволяющий обнаружить вирус ещё на начальном этапе болезни.
- для уточнения результатов при отрицательном исследовании на HBsAg;
- в качестве скринингового теста;
- для обследования лиц, контактирующих с больным гепатитом В;
- с целью контроля лечения;
- для обнаружения обострения хронического гепатита В.
Доктор может назначить этот анализ при наличии желтухи или цирроза печени, а также в случае лабораторных признаков поражения печени. Расшифровка результатов проводится врачом.
В некоторых случаях проводится количественный анализ ПЦР на гепатит С. По итогам исследования доктор получает числовое значение. Оно определяет вирусную нагрузку. Расшифровать анализ не трудно. Возможные такие результаты:
- вирус не обнаружен;
- вирус обнаружен, его концентрация составляет менее 100 МЕ/мл;
- вирус обнаружен, концентрация указывается в числовом выражении от 100 до 100 миллионов МЕ/мл;
- вирус выявлен в количестве более 100 миллионов МЕ/мл.
Назначается такое исследование в основном перед началом лечения для определения оптимальной терапевтической тактики. Кроме того, в процессе терапии оценка вирусологической нагрузки позволяет оценить эффективность применения медикаментозных средств.
На гепатит Б тоже проводится количественный тест ПЦР. Показания – аналогичные.
Метод выявления генотипа вирусов с помощью реакции амплификации нуклеиновых кислот используется также при многих других патологиях. Например, при папилломавирусной инфекции.
Сам факт наличия ВПЧ в организме установить нетрудно. Для этого достаточно осмотра – на коже и слизистых появляются бородавки или кондиломы. Но разные вирусы несут разную степень опасности. Некоторые из них всего лишь доставляют психологический дискомфорт, провоцируя появления бородавок. В то же время другие грозят злокачественными онкологическими новообразованиями. Чтобы понять, чего можно ждать от вируса, проводится ПЦР на онкогенные типы. В основном это типы 16, 18, а также 31 и 33.
Есть и более углубленные исследования. Они предполагают дополнительное определение других типов ВПЧ высокого онкогенного риска.
При обнаружении опасных вирусов избавиться от них все равно невозможно. Потому что не существует пока что препаратов, уничтожающих ВПЧ полностью. Но пациента с угрозой появления злокачественных новообразований берут под контроль. Он регулярно наблюдается у доктора.
В большинстве случаев рак не появляется на пустом месте. Особенно если речь идет о раке шейки матки – самом частом онкологическом процессе, который запускают вирусы папилломы. Ему предшествуют диспластические изменения. Их можно своевременно выявить и вылечить. Поэтому в случае обнаружения у женщины высокоонкогенных ВПЧ, она должна регулярно сдавать мазки на онкоцитологию и проходить гинекологические осмотры.
Качественный метод ПЦР имеет значительное отличие от количественного. Оно состоит в том, что результат выдается обнаружено или не обнаружено. Тогда как количественный дает числовое значение. Он необходим в ряде случаев. Например, чтобы оценить, прогрессирует ли болезнь (увеличилась ли вирусная нагрузка).
С помощью количественного исследования можно проверить, эффективно ли проходит терапия (уменьшилась ли вирусная нагрузка). Определяются показания к лечению заболевания. Например, при низкой концентрации патогена может применяться тактика наблюдения, а при увеличении популяции назначается лечение.
Существует большое количество видов полимеразной цепной реакции. Рассмотрим некоторые из них, которые активно используются в медицине.
Real Time PCR
Одной из разновидностью ПЦР является Real Time PCR. RT PCR предполагает определение ДНК возбудителя в режиме реального времени и оценку количества копий специфических фрагментов нуклеиновых кислот. Для этого могут использоваться различные методы. В основном применяется один из двух способов:
- ДНК-зонды;
- флюоресцентные красители.
Метод очень похож на обычную ПЦР. Здесь есть все те же самые этапы. Вначале проводится денатурация ДНК. Затем – отжиг праймеров. При RT PCR детекция продукта производится по мере его накопления. Методика широко используется в различных областях медицины и науки. В первую очередь это диагностика заболеваний. С помощью ПЦР в реальном времени можно оценить вирусную или бактериальную нагрузку. Оценивается эффективность лечения – врач смотрит, уменьшилось ли количество ДНК возбудителей в организме человека. Метод применяется и в онкологии. С его помощью можно провести детекцию атипичных клеток в солидной опухоли. А также определяются циркулирующие опухолевые клетки.
Real Time PCR применяется в микробиологии. Метод используется для оценки количественных показателей нормальной микрофлоры человека, например, в кишечнике или во влагалище.
RAPD – это не отдельный анализ. Это ПЦР-маркер. Он считается наиболее распространенным.
В ходе анализа используется единичный короткий праймер. Обычно он имеет 10 членов.
Нуклеотидная последовательность – произвольная. Иногда в RAPD используется сразу несколько праймеров.
PCR RFLP – способ определения ДНК путем её разрезания. Для этого используются ферменты эндонуклеазы рестрикции. В последующем фрагменты анализируются путем электрофореза. Метод используется для определения генов, отвечающих за различные заболевания, склонность к которым передается по наследству. А также для определения генетического родства двух людей.
ПЦР с обратной транскрипцией
Существует множество других видов ПЦР.
Реакция с обратной транскрипцией предполагает превращение РНК в одноцепочечную ДНК с помощью обратной транскриптазы. Затем проводится обычная ПЦР для анализа последовательности нуклеотидов.
Метод позволяет обнаружить РНК даже в минимальном количестве. Он применяется в диагностике ВИЧ и некоторых генетических заболеваний. Другие виды ПЦР:
- вложенная – особенностью является применение двух пар праймеров;
- инвертированная – предполагает несколько разрезаний и сшиваний ДНК, в результате чего известные фрагменты оказываются на двух концах неизвестного;
- асимметричная – предполагает использование избытка одного праймера;
- ступенчатая – проводится при температуре выше оптимальной, которая постепенно уменьшается до оптимума;
- виртуальная – проводится с помощью компьютерного анализа, который предсказывает потенциальную амплификацию ДНК.
ПЦР на герпес 6 типа
Анализ может использоваться для выявления любых вирусов. В том числе семейства герпеса.
Могут быть определены возбудители 1 и 2 типа. ВПГ 1 и 2 типа могут вызывать лабиальный или генитальный герпес. Первый чаще вызывает поражение губ. Второй – обычно вызывает воспалительные процессы мочеполовой системы.
Выявляются также:
- третий тип – ветряная оспа;
- четвертый – вирус Эпштейна-Барр;
- пятый – цитомегаловирус;
- шестой – розеоловирус;
- седьмой – провоцирующий саркому Капоши.
В нашей клинике можно обследоваться на любые инфекции методом ПЦР. Результаты анализов можно получить быстро, и при необходимости – анонимно.
источник
Качественный и количественный анализ — два фундаментальных метода сбора и интерпретации данных в исследованиях. Эти методы могут использоваться независимо или одновременно, поскольку все они имеют одни и те же цели. У них есть некоторые ошибки, и поэтому одновременное использование их может компенсировать ошибки, которые каждый из них имеет, а затем дает качественные результаты.
Более того, в количественном и качественном анализе имеются совпадения. В этой статье раскрываются ключевые различия между этими двумя методами анализа исследований.
Количественный анализ часто связан с численным анализом, когда данные собираются, классифицируются, а затем вычисляются для определенных результатов с использованием набора статистических методов. Данные выбираются случайным образом в больших образцах и затем анализируются. Преимущество количественного анализа результатов может быть применено в общей популяции с использованием моделей исследований, разработанных в образце. Это является недостатком качественного анализа данных из-за ограниченного обобщения результатов.
Количественный анализ носит более объективный характер. Он стремится понять возникновение событий, а затем описать их с использованием статистических методов. Однако более ясность может быть получена путем одновременного использования качественных и количественных методов. Количественный анализ обычно оставляет случайные и скудные события в результатах исследований, тогда как качественный анализ их рассматривает.
Количественный анализ обычно касается измеряемых величин, таких как вес, длина, температура, скорость, ширина и многое другое. Данные могут быть выражены в табличной форме или в любом графическом представлении с использованием графиков или диаграмм. Количественные данные можно классифицировать как непрерывные или дискретные, и их часто получают с помощью обследований, наблюдений, экспериментов или интервью.
Однако в количественном анализе имеются ограничения. Например, может быть сложно выявить относительно новые концепции, используя количественный анализ, и именно там, где качественный анализ входит в уравнение, чтобы выяснить «почему» возникает определенное явление. Вот почему методы часто используются одновременно.
Качественный анализ связан с анализом данных, которые не могут быть количественно определены. Этот тип данных касается понимания и понимания свойств и атрибутов объектов (участников). Качественный анализ может получить более глубокое понимание «почему» происходит определенное явление. Анализ может использоваться в сочетании с количественным анализом или предшествующим ему.
В отличие от количественного анализа, который ограничен определенными правилами или цифрами классификации, анализ качественных данных может быть широким и многогранным. И это субъективно, описательно, нестатистическое и исследовательское по своей природе.
Поскольку качественный анализ стремится получить более глубокое понимание, исследователь должен быть хорошо округлен с учетом каких-либо физических свойств или атрибутов, на которых основано исследование. Часто исследователь может иметь отношения с участниками, где раскрываются их характеристики. В количественном анализе характеристики объектов часто не раскрываются. Типичные проанализированные данные качественно включают цвет, пол, национальность, вкус, внешний вид и многое другое, пока данные не могут быть вычислены. Такие данные получены с помощью интервью или наблюдений.
В качественном анализе есть ограничения. Например, он не может быть использован для обобщения населения. Небольшие образцы используются в неструктурированном подходе, и они не являются репрезентативными для общей популяции, поэтому этот метод не может быть использован для обобщения всей популяции. Вот где количественный анализ в фактор.
Анализ качественных данных основан на классификации объектов (участников) в соответствии со свойствами и атрибутами, тогда как количественный анализ основан на классификации данных на основе вычислимых значений. Качественный анализ субъективен, тогда как количественный является объективным.
В качественном анализе данные собираются небольшими нерепрезентативными образцами неструктурированным способом. Типичные собранные данные включают цвет, расу, религию, национальность и многое другое. В количественном анализе, с другой стороны, данные собираются в больших репрезентативных выборках, которые могут обобщать всю популяцию.
Методика качественного анализа является исследовательской, где анализ стремится получить более глубокое понимание того, почему происходит определенное явление. Методология количественного анализа может быть убедительна, например, сколько или сколько раз происходит определенное явление, а не почему это происходит.
В качественном анализе результаты исследований специфичны для изучаемых объектов и не применимы к общей популяции, тогда как в количественном анализе результаты могут быть применимы для населения в целом.
В качественном анализе исследователи часто задают открытые вопросы, проводят собеседования и наблюдения, тогда как в количественном анализе исследователи проводят измерения, проводят опросы, эксперименты и наблюдения.
Качественный анализ направлен на более глубокое понимание социальных взаимодействий, в то время как количественный анализ направлен на проверку гипотез и даже дает будущие прогнозы
источник
Качественный и количественный анализ являются предметом аналитической химии. Аналитическая химия занимается исследованием экспериментальных методов определения состава веществ. Определение состава веществ включает выявление природы компонентов, из которых состоит исследуемое вещество, и установление количественных соотношений этих компонентов.
Сначала устанавливают качественный состав исследуемого объекта, т.е. решают вопрос, из чего он состоит, а затем приступают к определению количественного состава, т.е. узнают, в каких количественных соотношениях обнаруженные составные части находятся в объекте исследования.
Качественный анализ вещества можно проводить химическими, физическими, физико-химическими методами.
Химические методы анализаоснованы на применении характерных химических реакций для установления состава анализируемого вещества.
Химический анализ вещества проводят двумя способами: «сухим путем» или «мокрым путем». Анализ сухим путем — это химические реакции, происходящие с веществами при накаливании, сплавлении и окрашивании пламени.
Анализ мокрым способом — это химические реакции, протекающие в растворах электролитов. Анализируемое вещество предварительно растворяют в воде или других растворителях. В зависимости от массы или объема взятого для анализа вещества, от применяемой техники различают макро-, полумикро- и микрометоды.
Макрометод. Для проведения анализа берут 1-2 мл раствора, содержащего не менее 0,1 г вещества, и добавляют не менее 1 мл раствора реактива. Реакции проводят в пробирке, осадок отделяют фильтрованием. Осадок на фильтре промывают от примесей.
Полумикрометод. Для анализа берут в 10-20 раз меньше вещества (до 0,01 г). Так как в этом методе работают с малыми количествами вещества, то пользуются микропробирками, часовыми или предметными стеклами. Для отделения осадка от раствора применяют центрифугирование.
Микрометод. При выполнении анализа данным методом берут одну-две капли раствора, а сухого вещества — в пределах 0,001г. Характерные реакции проводят на часовом стекле или фарфоровой пластинке.
При проведении анализа пользуются следующими операциями: нагревание и выпаривание, осаждение, центрифугирование, проверка полноты осаждения, отделение раствора (центрифуга) от осадка, промывание и растворение осадка.
Нагревание растворов можно вести непосредственно пламенем газовой горелки, на асбестовой сетке или водяной бане. Небольшое количество раствора нагревают до температуры, не превышающей 100°С, на водяной бане, вода в которой должна кипеть равномерно.
Для концентрирования растворов применяют водяную баню. Выпаривание раствора до сухого остатка проводят в фарфоровых чашках или тиглях, нагревая их на асбестовой сетке. Если сухой остаток после выпаривания необходимо прокалить для удаления летучих солей, то тигель ставят на фарфоровый треугольник и нагревают пламенем газовой горелки.
Осаждение. Реакцию осаждения проводят в конических колбах или цилиндрической пробирках. В исследуемый раствор приливают пипеткой реактив-осадитель. Осадитель берут в избытке. Смесь тщательно перемешивают стеклянной палочкой и потирают о внутренние стенки пробирки, это ускоряет процесс образования осадка. Осаждение часто ведут из горячих растворов.
Центрифугирование. Осадок отделяют от раствора центрифугированием, используя ручную или электрическую центрифугу. Пробирку с раствором и осадком помещают в гильзу. Центрифуга должна быть загружена равномерно. При быстром вращении центробежная сила отбрасывает частицы осадка на дно и уплотняет его, а раствор (центрифугат) становится прозрачным. Время вращения составляет от 30 с до нескольких минут.
Проверка полноты осаждения. Пробирку осторожно вынимают из центрифуги и добавляют по стенке 1-2 капли реактива-осадителя к прозрачному раствору. Если раствор не мутнеет, значит осаждение полное. Если же наблюдается помутнение раствора, то в пробирку еще добавляют осадитель, содержимое перемешивают, нагревают и вновь центрифугируют, затем повторяют проверку полноты осаждения.
Отделение раствора (центрифугата) от осадка. Убедившись в полноте осаждения, отделяют раствор от осадка. Раствор от осадка отделяют капельной пипеткой. Пипетку закрывают указательным пальцем и осторожно вынимают из пробирки. Если отобранный раствор необходим для анализа, то его переносят в чистую пробирку. Для полного отделения операцию повторяют несколько раз. При центрифугировании осадок может плотно осесть на дно пробирки, тогда раствор отделяют декантацией (осторожно сливают).
Промывание осадка. Осадок (если он исследуется) необходимо хорошо отмыть; для этого приливают промывную жидкость, чаще всего дистиллированную воду. Содержимое тщательно перемешивают стеклянной палочкой и центрифугируют, затем промывную жидкость отделяют. Иногда в работе эту операцию повторяют 2-3 раза.
Растворение осадка. Для растворения осадка в пробирку добавляют растворитель, помешивая стеклянной палочкой. Нередко растворение осадка ведут при нагревании на водяной бане.
Для определения количественного состава вещества или продукта используются реакции нейтрализации, осаждения, окисления — восстановления, комплексообразования. Количество вещества можно определить по его массе или объему раствора, затраченного на взаимодействие с ним, а также по показателю преломления раствора, его электрической проводимости или интенсивности окраски и т.п.
По количеству взятого для исследования вещества аналитические методы количественного анализа классифицируются следующим образом: макроанализ — 1-10 г твердого вещества, 10-100 мл анализируемого раствора; полумикроанализ — 0,05-0,5 твердого вещества, 1-10 мл анализируемого раствора; микроанализ — 0,001-1-10- 4 г твердого вещества, 0,1-1*10- 4 мл анализируемогораствора. В товароведной практике часто пользуются гравиметрическим (весовым) и титриметрическим (объемным) методами.
Гравиметрический (весовой) анализ — один из методов количественного анализа, который позволяет определять состав анализируемого вещества путем измерения массы. Измерение массы (взвешивание) выполняется на аналитических весах с точностью 0,0002 г. Этот метод часто используется в пищевых лабораториях для определения влажности, зольности, содержания отдельных элементов или соединений. Анализ может быть выполнен одним из следующих способов.
1. Определяемую составную часть количественно (полностью, насколько это возможно) выделяют из исследуемого вещества и взвешивают. Так определяют зольность продуктов. Взвешенный на аналитических весах исходный продукт (навеску) сжигают, полученную золу доводят до постоянной массы (прокаливают до тех пор, пока не перестанет изменяться масса) и взвешивают.
Зольность продукта х (%) рассчитывают по формуле
,
где В — масса прокаленной золы, г;
А — исходная навеска продукта, г.
2. Из навески исходного вещества полностью удаляют определяемую составную часть и остаток взвешивают. Так определяют влажность продуктов, при этом навеску исходного вещества высушивают в сушильном шкафу до постоянной массы.
Влажность продукта х (%) рассчитывают по формуле
где А – исходная навеска продукта, г;
В – масса навески после высушивания, г.
Объемный анализ — метод количественного анализа, где искомое вещество определяют по объему реактива с точно известной концентрацией, затраченному на реакцию с этим веществом.
При определении объемным методом к известному объему раствора определяемого вещества малыми порциями (по каплям) добавляют реактив с точно известной концентрацией до тех пор, пока его количество не будет эквивалентно количеству определяемого вещества. Раствор реактива с точно известной концентрацией называется титрованным, рабочим или стандартным раствором.
Процесс медленного прибавления титрованного раствора к раствору определяемого вещества называется титрованием. Момент, когда количество титрованного раствора будет эквивалентно количеству определяемого вещества, называется точкой эквивалентности или теоретической точкой конца титрования. Для определения точки эквивалентности пользуются индикаторами, которые вблизи ее претерпевают видимые изменения, выражающиеся в изменении цвета раствора, появлении помутнения или выпадении осадка.
Важнейшие условия для правильного проведения объемно-аналитических определений: 1) возможность точного измерения объемов растворов; 2) наличие стандартных растворов с точно известной концентрацией; 3) возможность точного определения момента окончания реакции (правильный выбор индикатора).
В зависимости от того, на какой реакции основано определение, различают следующие разновидности объемного метода:
· метод окисления — восстановления
· метод осаждения и комплексообразования.
В основе метода нейтрализации лежит реакция взаимодействия ионов Н + и ОН — . Метод применяется для определения кислот, оснований и солей (которые реагируют с кислотами или основаниями) в растворе. Для определения кислот используют титрованные растворы щелочей КОН или NаОН, для определения оснований — растворы кислот НС1, Н2SO4.
Для определения содержания, например, кислоты в растворе точно отмеренный пипеткой объем раствора кислоты в присутствии индикатора титруют раствором щелочи точно известной концентрации. Точку эквивалентности определяют по изменению цвета индикатора. По объему щелочи, израсходованной на титрование, вычисляют содержание кислоты в растворе.
Метод окисления — восстановления основан на окислительно-восстановительных реакциях, происходящих между стандартным раствором и определяемым веществом. Если стандартный раствор содержит окислитель (восстановитель), то определяемое вещество должно содержать соответственно восстановитель (окислитель). Метод окисления-восстановления подразделяется, в зависимости от используемого стандартного раствора на метод перманганатометрии, метод иодометрии и др.
В основе метода осаждения лежат реакции, сопровождающиеся выпадением осадка. В отличие от гравиметрического метода обработку осадка здесь не производят, массу исследуемого вещества определяют по объему реактива, израсходованному на реакцию осаждения.
Не нашли то, что искали? Воспользуйтесь поиском:
источник
Полимеразно-цепная реакция считается одним из самых точных и быстрых методов диагностики многих инфекционных заболеваний. Успешно применяется она также в криминологии для упрощения процесса идентификации преступников, с ее помощью с высокой точностью устанавливают отцовство.
Каждый живой организм, в том числе бактерии и вирусы, имеют уникальные гены, входящие в структуру ДНК или РНК в определенной последовательности. Во время исследования методом ПЦР генетический материал многократно копируется под воздействием ДНК-полимеразы и специальных температурных циклов.
Существуют два основных метода полимеразно-цепной реакции:
- Классический метод — выделение генетического материала возбудителя методом электрофореза;
- ПЦР в режиме «реального времени».
Методика состоит из трех основных этапов:
- Подготовка исследуемого образца;
- Амплификация ДНК;
- Детекция (идентификация) генетического материала предполагаемого возбудителя.
Для проведения исследования ПЦР-лаборатория должна быть разделена на 3 зоны, каждый этап реакции проводится строго в предназначенном для него помещении. Каждая зона должна быть снабжена необходимым оборудованием, дозаторами, расходным материалом, защитной одеждой, используемыми только в данном помещении.
После регистрации и маркировки образцов, в кабинете пробоподготовки происходит выделение ДНК или РНК возбудителя из исследуемого материала путем воздействия определенной температуры и специальных реагентов. Затем начинается процесс амплификации – создания многочисленный копий уникального фрагмента ДНК. Он состоит из 3 основных этапов:
- Денатурация ДНК – под воздействием высокой температуры (95 градусов) двойная спираль ДНК расплетается на 2 цепочки.
- Отжиг праймеров – к окончаниям цепей ДНК присоединяются специальные синтетические соединения (праймеры), идентичные генетической информации на концах искомых фрагментов нуклеиновых кислот. Температура, нужная для присоединения праймера, индивидуальна для конкретного случая, колеблется в диапазоне от 50 до 65 гр.С.
- При помощи фермента ДНК-полимеразы при 70 – 72 градусов между двумя праймерами достраивается аналогичный участок ДНК (ампликон). В качестве «строительного материала» используются специальные вещества, добавляемые в пробирку.
Циклы амплификации повторяются несколько раз, следовательно, выделяемая ДНК многократно копируется, что упрощает процесс ее идентификации. Идентификация может проводиться визуально после проведения процедуры электрофореза продуктов амплификации в агарозном геле, либо автоматически при использовании методики реал тайм.
При исследовании методом ПЦР в режиме «реального времени» амплификация и детекция происходят одновременно в специальных приборах. Данный метод наиболее предпочтительный, так как исследование проводится в закрытых пробирках, снижается риск контаминации и, следовательно, выдачи ложно-положительных результатов.
- Исследование занимает всего несколько часов, в отличие от длительных классических микробиологических методов;
- Высокая специфичность от 95% до 100%, т.к. искомый фрагмент ДНК уникален для каждого конкретного микроорганизма;
- Высокая чувствительность метода, обнаружить возбудителя можно, даже если в исследуемом образце он представлен всего одной клеткой;
- Идентифицировать возбудителя можно как качественным, так и количественным методом. Это очень важно при выделении условно-патогенных микроорганизмов, которые в небольшом количестве не вызывают заболевания;
- Возможность определить генотип возбудителя (гепатит С, ВИЧ-инфекция). Необходимо это для рационального лечения и прогноза возможных осложнений;
- Возможность выявить генетическую предрасположенность к болезни, тем самым предупредить ее развитие;
- Можно выделить практически любой источник инфекции, также современные методики позволяют выявить совокупную микрофлору в исследуемом образце, например, биоценоз влагалища.
- Возможность получения как ложноположительного, так и ложноотрицательного образца при несоблюдении правил забора образца, ошибок при проведении исследования;
- Высокая стоимость анализа.
Исследовать методом ПЦР можно практически любой образец (кровь, моча, ликвор, соскобы с цервикального канала и уретры, волосяные луковицы, сперма и т.д.). Широко используется данная методика для диагностики ЗППП (гонорея, хламидиоз, уреаплазмоз, микоплазмоз, трихомониаз). С ее помощью можно выявить возбудителей туберкулеза, дифтерии, пневмонии, вирусных гепатитов, ВИЧ-инфекции, токсоплазмоза, цитомегаловирусной и герпетической инфекции, сальмонеллеза и др.
Применяется полимеразно-цепная реакция для установления отцовства путем сравнения ДНК родителя и ребенка, выявления генетических аномалий и наследственной предрасположенности организма к различным заболеваниям.
- Кровь рекомендуется сдавать строго натощак.
- Перед взятием мазка из уретры или цервикального канала следует в течение трех дней воздержаться от половой жизни, сдавать анализ необходимо не раньше, чем через месяц после окончания курса антибиотикотерапии, иначе результат может быть ложноположительным. Методом ПЦР выявляется ДНК даже мертвого возбудителя, поэтому проводить исследование лучше после полного обновления клеток.
- Мочу следует собирать в стерильную емкость.
Ответ чаще всего будет готов через пару дней, в зависимости от возможностей лаборатории.
При использовании качественной методики может быть только 2 варианта ответа: положительный или отрицательный. Положительный результат свидетельствует о наличии выделяемого микроорганизма в образце, отрицательный – об отсутствии.
Количественный результат должен оценивать лечащий врач, применяется индивидуальный подход в каждом конкретном случае. Специалист, учитывая полученный ответ, решает вопрос о необходимости лечения, дозировке препаратов, уточняет форму и стадию заболевания.
При определении генетического профиля (предрасположенности к тромбофилии, раку молочной железы) после расшифровки результата врач может оценить степень риска развития заболевания, а также назначить специальную диету, профилактические мероприятия.
Страничка оказалась полезной? Поделитесь ею в своей любимой соцсети!
источник
ПЦР анализ (6, 12): что это такое и как делают, расшифровка, качественная и количественная ПЦР в диагностике инфекций
Открытый в 1983 году американским ученым и лауреатом Нобелевской премии Кэри Мюллисом, он стал настоящим прорывом в сфере ранней диагностики инфекционных заболеваний. Дорогостоящий и сложный, однако очень информативный и точный, ПЦР помогает обнаружить в организме человека вирусы и бактерии даже в единичном количестве.
ПЦР относится к молекулярно-генетическим тестам. Его работа основана на определении фрагментов ДНК и РНК возбудителей инфекции по определенной последовательности нуклеотидов в цепочке. Суть метода состоит в активизации репликации генетического материала бактерии или вируса. Чтобы запустить реакцию, достаточно единичных фрагментов ДНК или РНК патогена.
Анализ проводится в лабораторных условиях. С помощью специальных ферментных систем, специфических для искомой инфекции, ускоряется деление генетического материала патогена — каждый раз удваивается. Цепная реакция включает множество циклов. При каждом из них количество фрагментов нуклеотидных цепочек увеличивается в геометрической прогрессии. По окончании теста маркеров возбудителя становится настолько много, что определить их не составляет сложности.
Получается, если изначально в материале был фрагмент генетического материала вируса или бактерии, который было невозможно обнаружить, после ПЦР количество увеличивается в десятки раз и выявить его просто.
Метод ПЦР считается ультрачувствительным. Он отражает наличие инфекции в организме, даже если заражение состоялось недавно, иммунитет не успел на него отреагировать, а численность инфекционных агентов минимальна.
Бактерии или вирусы вносят изменения в ДНК человека, другими словами, «оставляют отпечатки». Реактивы, используемые при ПЦР, отыскивают их и заставляют многократно делиться. Поэтому установить инфицирование можно всегда, даже если заболевание развивается бессимптомно или возбудитель персистирует в латентном режиме.
ПЦР считается очень специфичным анализом. Ферментные системы нацелены на конкретный антиген и активны только против него. Достоверность метода достигает 100%. Если внутри организма нет малейших признаков искомой инфекции, то бишь, конкретной последовательности нуклеотидов (уникальна для каждого живого существа), исследование не даст положительный результат. Исключения есть, но они сведены к минимуму, поэтому ПЦР признан еще и высокоточным анализом.
Возможность сочетания ферментных систем, определения сразу нескольких видов инфекции, а также вероятность ее обнаружения в абсолютно любой биологической жидкости делает исследование универсальным. Наиболее активно ПЦР применяется в гинекологии и урологии, поскольку здесь распространены заболевания вирусной и бактериальной природы, среди которых, сложно диагностируемые и развивающиеся скрыто.
Примером активного применения ПЦР выступает тест на отцовство. Другие сферы медицины его чаще используют при симптомах инфекционных патологий, повышенном риске их хронизации, высокой вероятности заражения больного опасными для жизни вирусами (гепатит, ВИЧ).
Гинекологи, андрологи и урологи назначают ПЦР на ИППП (Инфекции, Передающиеся Половым Путем), для выявления скрытых заболеваний. Кроме того, с его помощью можно найти признаки онкологического процесса, определенные иммуноглобулины. Все сильнее набирает популярность анализ ПЦР на туберкулез, применяется для обнаружения хеликобактер пилори, как основного провокатора гастрита и язвенной болезни желудка (на ПЦР отправляют кал или желудочное содержимое).
Частные лаборатории предоставляют возможность сделать комплексный скрининг. Можно пройти обследование сразу на 6, 12 инфекций.
Таблица — О каких возбудителях информируют комплексные анализы
p, blockquote 14,0,0,0,0 —>
| Инфекция | ПЦР6 | ПЦР12 |
| Микоплазма гениталиум | + | + |
| Микоплазма гоминис | + | + |
| Трихомонады | + | + |
| Хламидии | + | + |
| Уреаплазмы | + | + |
| Кандиды | — | + |
| Гарднереллы | + | + |
| Гонококк | — | + |
| Ig M | — | + |
| Ig G | — | + |
| Герпес 1 | — | + |
| Герпес 2 | — | + |
С помощью метода выявляют некоторых паразитов (проводят ПЦР на лямблии, описторхов, аскарид), если анализ кала показывает отрицательный результат, несмотря на наличие симптоматики. С его помощью обнаруживают возбудителя гепатитов А, B, C, D, сифилис, Эпштейна-Барра, цитомегало-, папилломавирус.
Общие правила подготовительного периода перед любым анализом ПЦР включают:
p, blockquote 16,0,0,0,0 —>
- исключение приема антибиотиков за 3 недели до теста;
- исключение половых контактов за 2 суток;
- соблюдение техники сбора материала (при домашней подготовке);
- применение только стерильной аптечной тары для предоставления проб.
Нюансы зависят от того, какой именно биоматериал будет тестировать лаборатория. Должна сдаваться только та биологическая жидкость, которая вероятнее всего содержит наибольшие концентрации возбудителя. Если это моча, кал, мокрота, слюна, сперма, возможен самостоятельный сбор. Другие типы (мазки из цервикального или уретрального канала, ротоглотки, конъюнктивы) берет медицинский персонал в условиях медицинского учреждения.
Забор проводит лаборант одноразовой вакуумной системой или шприцем. Для тестирования достаточно 1‒2 мл. Биоматериал собирают с утра, натощак. Специфических условий подготовки нет, как и потребности снижения физических нагрузок, исключения каких-либо продуктов накануне. Единственное требование — должно пройти достаточно времени после антибиотикотерапии.
Чаще всего изучается при подозрениях на резистентные к лечению инфекции мочевыводящих органов. Биоматериал — утренняя урина, собранная вскоре после пробуждения, перед завтраком. Для доставки пробы используют стерильный контейнер с крышкой, приобретенный в аптеке или выданный лабораторией. Собирают только среднюю порцию (первую и последнюю спускают в унитаз). Сразу закрывают, транспортируют для анализа на протяжении 2 часов.
Накануне не желательно принимать диуретики или увеличивать обычный суточный объем жидкости. Женщинам нельзя спринцеваться за 3 суток. За 2 дня представители обоих полов должны отказаться от секса. Перед анализом нельзя принимать нефропротекторы с растительным составом, уроантисептики. Перед сбором мочи нужно не забыть подмыться, чтобы бактерии с наружных половых органов не попали в биоматериал.
Забор делают в лаборатории или поликлинике. Наружное отверстие уретры очищают от выделений с помощью физраствора. Специальную щетку со щетинистой головкой погружают на 2‒4 см в уретральный канал, делают циркулярное движение, извлекают приспособление и основную контактирующую часть срезают в пробирку со специальным раствором (выступает своеобразной питательной средой).
Непосредственно перед анализом за 3 часа нельзя мочиться. Запрещается проводить гигиенические процедуры с использованием антисептиков или антибактериальных растворов. Нельзя спринцеваться и заниматься сексом за 2 суток до диагностики.
Проводятся в лаборатории. Женщина занимает положение в гинекологическом кресле. Лаборант или врач с помощью физраствора убирает слизь и выделения бартолиновых желез снаружи половых органов. Если необходим мазок из влагалища, специальным зондом со щетинистой головкой делают циркулярное движение в нижней части заднего свода. Рабочую часть устройства срезают в пробирку с раствором. При заборе из цервикального канала зонд погружают вглубь шейки до 1,5 см.
ПЦР влагалищного мазка часто назначают беременным женщинам, при симптомах ИППП или повышенном риске их хронизации, а также при поисках причин бесплодия. Перед анализом нельзя иметь интимные связи, спринцеваться, использовать антисептики для подмываний или свечи с антибактериальным действием.
Берет лаборант или врач. Головкой зонда проводят по задней стенке глотки, миндалинам, небным сводам, которую затем срезают в пробирку. Анализ берут строго натощак. Перед ним нельзя использовать антибактериальные спреи или леденцы.
Для выявления возбудителя туберкулеза анализируют мокроту, которую больной собирает с утра с помощью стерильного контейнера (подходит также для ПЦР слюны). Кал также сдают в специальной емкости, причем нет смысла наполнять ее. Достаточно просто взять небольшую пробу ложкой, которой укомплектован стерильный сосуд.
Забор мазка из конъюнктивы проводит лаборант, снимая образец с поверхности нижнего века. Содержимое желудка получают аспирационным путем, при гастроскопии. На анализ могут отправить массы, или биоптат со стенки органа.
Полимеразная цепная реакция способна отразить не только наличие возбудителя, но также его примерную концентрацию в единице биоматериала (например, 1 мл крови, мочи, слюны). Выявление, а также идентификация бактерий либо вируса называется качественным ПЦР-анализом. Он может дать только 2 варианта ответа — есть возбудитель в организме или нет.
Это уместно для диагностики заболеваний даже на ранних сроках после заражения. С помощью ПЦР можно проверить наличие инфекции в крови в инкубационном периоде развития или во время «серологического окна» (когда иммунитет еще не выработал антитела, а ИФА-тест отражает отрицательный результат, несмотря на высокую вероятность заражения). Нормой по всем возбудителям считается отрицательный результат. Если он положительный — в организме есть инфекция.
Чтобы оценить концентрацию болезнетворных агентов, проводят количественные ПЦР анализы. Они указывают, сколько именно копий РНК или ДНК возбудителя обнаружено в расчете на единицу измерения биоматериала. Результат указывают в международных единицах (МЕ/мл). Количественный тест определяет:
p, blockquote 31,0,0,0,0 —>
- вирусную или бактериологическую нагрузку на организм;
- степень активности инфекции;
- необходимость начала терапии;
- эффективность назначенного лечения.
Качественный и количественный ПЦР одинаково важны при диагностике и лечении ВПЧ, ВИЧ, гепатита С. При перечисленных заболеваниях назначают мощные противовирусные препараты, а контроль изменения концентрации возбудителя позволяет корректировать дозы, снижая риск развития побочных эффектов. Хорошим анализом считается такой, результат которого приближен к минимальному порогу чувствительности теста (10-50 МЕ/мл), однако это не исключает необходимости продолжать терапию.
Информативность ПЦР анализа и его точность актуальны при диагностике многих заболеваний. Однако метод этот сложный, а его выполнение требует строгого соблюдения техники и правил. В противном случае возможно получение не достоверного результата (ложного). Ложноположительные данные получаются при:
p, blockquote 33,0,0,0,0 —>
- попадании в пробу соскоба крови;
- загрязнениями биоматериала примесями эпителия и слизи;
- нарушении стерильности условий проведения анализа.
Ложноотрицательный результат теста возможен при неправильной транспортировке проб в лабораторию (нарушения температурного режима, воздействие внешних условий), применении непригодных для анализа реактивов.
Один из разновидностей ПЦР анализа — ПЦР real-time. Особенностью исследования является более тщательное изучение и дифференциация материала, потенциально относящегося к патологическому. Удобнее объяснить разницу на примерах.
После лечения какой-то инфекции антибиотиками в организме человека еще некоторое время будут находиться остатки патогенов (их клеточные стенки, части РНК или ДНК). Проведение обычной ПЦР сразу после лечения также даст положительный результат, но инфекции как таковой уже нет. Именно поэтому для достоверности анализа рекомендуется соблюдать интервал после терапии антибиотиками минимум в три недели.
Выполнение ПЦР real-time сразу после лечения даже при наличии фрагментов патогенов, но при отсутствии активных форм, даст отрицательный результат. То есть это более чувствительный анализ, который лишен мельчайших недостатков.
Вопрос: Где лучше сдавать анализ, в частной или государственной лаборатории?
Ответ: Проходить исследование следует в крупных и известных медицинских учреждениях. Как правило, они располагают наиболее современным и высокоточным оборудованием, качественными реактивами. Это повышает информативность теста и его точность. Кроме того, частные лаборатории обеспечивают пациентов расходниками, необходимыми для правильной доставки проб.
Вопрос: Сдавать мазок из уретры больно или нет? Все знакомые говорят по-разному.
Ответ: Ощущения сугубо субъективные. Как правило, женщины переносят процедуру легко. Мужчины испытывают дискомфорт, что спровоцировано анатомическими особенностями строения уретры. Задача лаборанта — не допустить попадание крови в образец, поэтому нужно быть готовым к незначительным и кратковременным неприятным ощущениям.
Вопрос: Сколько делается комплексный анализ ПЦР? Можно ли попросить сделать тест срочно?
Ответ: Продолжительность проведения анализа варьируется от 5 до 8 часов. Процесс обработки результатов может занять несколько больше времени. Рассчитывать на результат можно спустя 1‒2 суток. Крупные, оснащенные по последнему слову техники лаборатории могут предоставить протокол исследования через несколько часов. Вопрос срочности следует решать индивидуально.
Вопрос: Можно ли сдавать полимеразную цепную реакцию вместо пробы Манту? Например, собирая ребенка в детский сад?
Ответ: Возможность замены тестов следует обсуждать с руководством заведения. Некоторые детсады и школы действительно разрешают приносить результаты ПЦР на туберкулез родителям, которые не хотят делать своим детям Манту. Однако нужно учитывать, что достоверность анализа относительно микобактерий туберкулеза несколько снижена, что обусловлено различными концентрациями возбудителя в биологических средах организма. Чтобы получить точный результат, следует сдавать на ПЦР мазок из зева, мокроту либо мочу.
Вопрос: Почему ИФА показывает положительный результат, а ПЦР — отрицательный?
Ответ: Иммуноферментный анализ направлен на поиск в крови антител к специфическим антигенам инфекций. Метод отражает не только сам факт заражения, но и реакцию иммунитета на этот процесс. ПЦР ищет непосредственно возбудителя. ИФА будет положительным еще некоторое время после лечения антибиотиками, тогда как ПЦР покажет отсутствие инфекции в крови. Кроме того, на похожие антигены могут вырабатываться сходные антитела, что также обуславливает позитивный результат ИФА при негативном тесте ПЦР. Редко для дополнения теста ИФА приходится сдавать бакпосев.
ПЦР — универсальный, точный, специфичный и информативный способ диагностики инфекционных заболеваний. Его используют для раннего обнаружения опасных бактерий и вирусов в организме. Референтное значение результата анализа — «отрицательный» относительно всех искомых возбудителей. Тест назначают для идентификации провокатора заболевания и правильного подбора терапии. ПЦР применяется и в процессе лечения, для определения вирусной нагрузки.
источник