Во время вынашивания плода будущей матери необходимо беречь свой организм от инфекционных болезней. Среди них есть такие патологии, которые передаются внутриутробным путем от женщины к эмбриону. Эти заболевания крайне отрицательно сказываются на развитии зародыша, вызывают аномалии и уродства у будущего ребенка. Их называют ТОРЧ-инфекциями. В тяжелых случаях такие болезни могут привести даже к гибели плода.
Слово TORCH (ТОРЧ) представляет собой аббревиатуру английских слов, которые обозначают различные заболевания:
- T (toxoplasmosis) — токсоплазмоз;
- O (other) — другие инфекции;
- R (rubeola) — краснуха;
- C (cytomegalia) — цитомегалия;
- H (herpes) — герпес.
Кроме этого, слово torch в переводе с английского означает «факел», что подчеркивает опасность этих заболеваний.
В группу «другие инфекции» (other) входят такие болезни, как хламидиоз, сифилис, гонорея, листериоз, гепатит, грипп, ветряная оспа, папилломатоз, а также патологии, вызванные энтеровирусами.
ТОРЧ-инфекции у беременных могут протекать в легкой форме или бессимптомно. Однако в любом случае они очень легко передаются плоду. Это связано со следующими факторами:
- Многие бактерии и вирусы имеют специфическую направленность против эмбриональных тканей.
- В организме человеческого зародыша метаболизм ускорен, поэтому его клетки становятся благоприятной средой для развития микроорганизмов.
ТОРЧ-инфекции могут иметь различный механизм развития. Это зависит от тяжести симптомов патологии у будущей матери, формы заболевания, а также от срока беременности.
Если заражение плода произошло с 1 по 8 неделю беременности, то возможна гибель эмбриона, выкидыш, формирование различных аномалий развития или фетоплацентарной недостаточности.
Инфицирование во время 9-28 недели внутриутробного развития приводит к нарушению формирования органов. Может возникнуть гидронефроз (расширение и атрофия почек) или гидроцефалия (водянка головного мозга).
На более поздних стадиях развития у плода начинает работать иммунная защита против болезнетворных микроорганизмов. Однако и в этот период заражение эмбриона может привести к негативным последствиям. Ребенок может родиться недоношенным, с малым весом и признаками инфекции.
Плацента защищает будущего малыша от негативных воздействий. Однако бактерии и вирусы способны проникать через этот барьер. Чаще всего ТОРЧ-инфекции передаются трансплацентарным путем. Этот способ распространения характерен для всех вирусов, а также для листерий, бледной трепонемы (возбудителя сифилиса). токсоплазм.
Возбудитель гонореи (гонококк) обычно распространяется восходящим путем. Сначала этот микроорганизм заражает околоплодные воды, а затем от них инфицируется эмбрион.
Заражение ребенка может произойти при рождении. Такой путь передачи характерен для хламидий, уреаплазмы, вируса герпеса и папилломы человека (ВПЧ). В очень редких случаях возможен гематогенный путь передачи, когда инфекция попадает в эмбрион с кровотоком из очага в организме женщины.
Симптомы ТОРЧ-инфекций можно подразделить на общие и специфические. Общие признаки этих патологий характерны для всех заболеваний, передающихся внутриутробным путем. Можно выделить следующие проявления, характерные для всех инфекций:
- Заражение на ранних стадиях беременности приводит к смерти плода и выкидышу.
- Также инфицирование на малых сроках беременности может вызвать пороки сердца, микро- или гидроцефалию, отклонения в строении рук и ног.
- Заражение во 2 и 3 триместре приводит к пневмонии, поражению органа зрения, увеличению печени и селезенки, задержке развития.
Важно помнить, что последствия внутриутробного заражения не всегда заметны при рождении ребенка. Они могут проявиться через несколько месяцев или даже лет после появления ребенка на свет.
Далее будут рассмотрены специфические проявления заболеваний.
Токсоплазмоз — это паразитарная патология, которую вызывают простейшие микроорганизмы. Женщина может заразиться этим заболеванием от животных (чаще всего от кошек) или при употреблении непрожаренного мяса. У беременной повышается температура, появляется слабость, ломота в суставах, общее недомогание, увеличение лимфоузлов.
Если мать больна, то плод заражается примерно в трети случаев. Токсоплазма является внутриклеточным паразитом и легко проникает через плаценту. У будущего ребенка возникают поражения мозга, глаз, сердца и печени. Если инфицирование произошло на ранних сроках беременности, то плод чаще всего гибнет и происходит выкидыш.
При заражении эмбриона на поздних сроках поражение не так сильно выражено. Однако заболевание может сказаться на здоровье ребенка через несколько лет после рождения. Это выражается в эндокринных нарушениях, ухудшении слуха и зрения у малыша.
Если же женщина переболела токсоплазмозом более чем за 6 месяцев до беременности, то это никак не скажется на организме будущего ребенка.
Эта ТОРЧ-инфекция наиболее опасна для беременной женщины. Если будущая мать в прошлом переболела краснухой, то контакт с больными людьми для нее не опасен. Это заболевание оставляет стойкий иммунитет. Если же женщина до беременности не перенесла это заболевание, то ей нужно избегать контактов с носителями ТОРЧ-инфекции такого вида. Эта патология очень легко передается воздушно-капельным путем.
Инфицирование плода этим вирусом в первом триместре приводит в 50 % случаев к синдрому врожденной краснухи. Возбудитель проникает через плаценту. В результате ребенок рождается с катарактой, глаукомой, пороками сердца и центральной нервной системы, аномалиями развития мочеполовых органов и ЖКТ. Заражение эмбриона на 13-16 неделе приводит к врожденной глухоте. На более поздних сроках плод заражается очень редко.
Чтобы избежать опасных последствий, лучше предотвратить такую ТОРЧ-инфекцию заранее. Для этого нужно сделать прививку от краснухи еще до зачатия малыша.
Для плода опасен герпес на губах (вирус первого типа) и на гениталиях (второй тип). Если будущая мать в прошлом перенесла это заболевание, то плод отчасти защищен антителами. Однако следует помнить, что эта патология вызывается вирусом, который навсегда остается в клетках. При неблагоприятных условиях микроорганизм может вновь активироваться. Поэтому во время беременности необходима профилактика острой формы заболевания.
Если будущая мать впервые заражается герпесом на ранних сроках беременности, то это может привести к гибели плода и выкидышу. Также могут отмечаться пороки развития различных органов: сердца, ЖКТ. Нередко формируется водянка головного мозга.
Если заболевание у матери возникает во втором и третьем триместре, то это чревато тем, что ребенок может родиться глухим или слепым. Малыш может страдать эпилепсией или ДЦП.
При инфицировании во время родов у ребенка может отмечаться врожденный герпес. При этом состоянии у младенца наблюдается желтуха, увеличение печени и поражение центральной нервной системы. Примерно в половине случаев такие дети погибают. Поэтому, если женщина заразилась герпетической инфекцией в последние недели беременности, ей показано кесарево сечение.
Если женщина заразилась цитомегаловирусом во время беременности, то это может иметь крайне опасные последствия для плода. Возбудитель заболевания легко проникает через плаценту. У зараженного эмбриона могут сформироваться тяжелые поражения центральной нервной системы и печени. Часто такие дети страдают глухотой и задержкой психомоторного развития. Они появляются на свет с врожденной цитомегалией. Смертность при такой форме болезни может достигать 30 %.
Нередко последствия внутриутробного заражения сказываются на ребенке только в возрасте 3-4 года. Малыш начинает отставать в развитии, у него резко ухудшается слух и зрение.
Однако если женщина заразилась цитомегалией до беременности, то заболевание обычно не отражается на здоровье будущего ребенка.
Кроме вышеперечисленных заболеваний, есть и другие инфекционные патологии, которые относятся к группе ТОРЧ. Опасными для плода могут быть следующие болезни будущей матери:
- Корь, грипп, ветрянка. Эти заболевания не вызывают серьезных аномалий развития. Однако в первом триместре беременности такие инфекции существенно повышают риск выкидыша.
- Вирус Коксаки (энтеровирус). Внутриутробное заражение обычно происходит во второй половине беременности. Врожденная инфекция приводит к судорогам, рвоте, высокой температуре, поражению горла и высыпаниям на коже у младенца.
- Хламидиоз. Этими бактериями малыш обычно инфицируется при рождении. Признаки заболевания развиваются поздно. Примерно через месяц после рождения могут проявиться симптомы тяжелого конъюнктивита, а спустя 2 — 3 месяца возникает пневмония.
- Врожденный уреаплазмоз. Это заболевание у младенцев отмечается довольно редко. При врожденной форме патологии у детей наблюдается пневмония, бронхит и сниженная масса тела.
- Вирус папилломы человека. Этим заболеванием малыш инфицируется в процессе родов. На теле ребенка заметны папилломы, обычно они локализуются в кожных складках, а также на лице и шее.
- Гепатит. Обычно заражение происходит во время родов, реже — внутриутробным путем. Больной новорожденный плохо ест, выглядит вялым и слабым. Затем у младенца резко повышается температура, появляется желтушность кожи и диарея.
- Гонорея. Чаще всего возбудитель заболевания поражает глаза у новорожденных детей. Возникает гонококковый конъюнктивит, который сопровождается покраснением век, гнойными выделениями из глаз, ухудшением общего состояния. У новорожденных девочек гонококк может поражать половые органы. Это проявляется в отечности половых губ, воспалении мочеиспускательного канала и влагалища, гнойных выделениях. Из-за боли малыш становится беспокойным, плачет и кричит во время мочеиспускания.
- Сифилис. При внутриутробном заражении признаки заболевания проявляются в течение первого месяца жизни ребенка. Сначала появляются симптомы, напоминающие простуду или грипп. Затем возникает сыпь, увеличиваются лимфоузлы, печень и селезенка. Младенец страдает от сильной боли в суставах.
- Листериоз. Если заражение эмбриона возникло на ранних стадиях, то происходит выкидыш. Инфицирование плода на поздних сроках беременности в 80 % случаев приводит к смерти новорожденного. Выжившие малыши страдают сепсисом, менингитом и пневмонией.
Чтобы избежать тяжелых последствий для плода таких заболеваний, необходимо пройти диагностику ТОРЧ-инфекций. Исследование проводят методом иммуноферментного анализа. В крови пациентки определяют антитела к бактериям и вирусам. При остром заболевании выявляются иммуноглобулины M, а при хроническом — антитела класса G.
Этот анализ необходимо сдать несколько раз. Впервые проводят исследование на ТОРЧ-инфекции при планировании беременности. Анализ необходимо сделать за 2-3 месяца до предполагаемого зачатия. Затем этот тест повторяют во время вынашивания плода на следующих сроках:
- до 15 недель (при постановке на учет);
- в 24-26 недель;
- в 34-36 недель.
Анализ на ТОРЧ-инфекции также необходимо пройти перед процедурой экстракорпорального оплодотворения.
Направление на исследование можно взять у лечащего акушера-гинеколога в женской консультации. Обычно назначают анализ на антитела к возбудителям краснухи, токсоплазмоза, герпеса и цитомегалии. Если есть необходимость, то врач может назначить более расширенный анализ на ТОРЧ-инфекции. В этом случае в исследовании выявляют и других возбудителей, например, хламидии или листерии.
Как сдавать анализ на ТОРЧ-инфекции? Это исследование не требует специальной подготовки. Кровь берут из вены натощак. Накануне исследования нельзя употреблять жирную пищу.
Сколько делается анализ на ТОРЧ-инфекции? Это зависит от клинической лаборатории, в которой проводится исследование. В среднем обработка результатов теста занимает 1-2 дня.
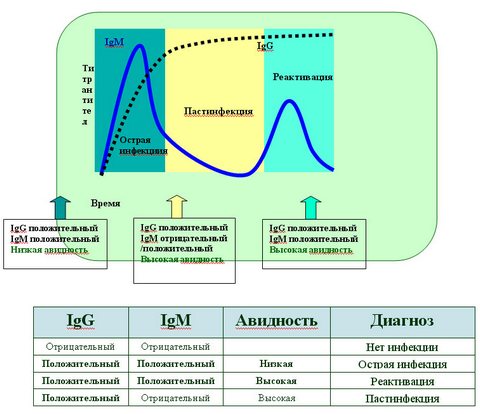
В расшифровке анализа на ТОРЧ-инфекции в первом столбце таблицы перечислены виды возбудителей болезней. Во второй колонке указано — обнаружены ли антитела класса IgG, а в третьей — выявлены ли иммуноглобулины IgM.
Если в крови не обнаружены антитела класса G и M, то это означает, что женщина здорова и никогда в прошлым не болела данным заболеванием. Однако такой результат свидетельствует и об отсутствии иммунитета против таких инфекций. В этом случае будущей матери необходимо беречь себя от возможного заражения и регулярно сдавать анализ крови на ТОРЧ-инфекции.
Если у пациентки выявлены антитела IgM, но нет иммуноглобулинов IgG, то это означает, что женщина в прошлом переболела данным заболеванием и у нее выработался иммунитет. В этом случае опасности для ребенка нет.
Если в расшифровке анализа на ТОРЧ-инфекции указано, что в крови присутствуют антитела класса G и M, то это означает обострение хронического заболевания. Существует опасность внутриутробного заражения эмбриона. В этом случае проводят дополнительный тест на авидность иммуноглобулинов.
Если у пациентки обнаружены антитела класса M, но нет антител класса G, то это говорит о том, что она инфицировалась недавно и болеет в острой форме. В таких случаях опасность заражения плода очень высока. Необходимо сделать УЗИ эмбриона. Если это обследование показывает наличие патологии у зародыша, то назначают анализ околоплодных вод (амниоцентез или кордоцентез).
Лечение ТОРЧ-инфекций зависит от состояния женщины. Важно уточнить: беременна ли пациентка в данный момент или только планирует зачатие ребенка. Если обследование выявило заболевание на этапе планирования беременности, то проводится полный курс антибактериальной или антивирусной терапии.
Ситуация значительно усложняется, если анализ показал инфицирование в период вынашивания плода. Если болезнь выявлена в первом триместре и представляет серьезную опасность для развития ребенка, то врачи чаще всего рекомендуют прервать беременность.
Если же заражение произошло во втором или третьем триместре, то необходима консультация опытного инфекциониста. Врач поможет подобрать наиболее щадящие антибактериальные и антивирусные препараты, которые обладают минимумом побочных эффектов. Очень важно провести и лечение ребенка после рождения. Оно включает в себя назначение антимикробных средств, а также коррекцию аномалий развития и нарушений функций внутренних органов.
источник
*Импакт фактор за 2017 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
TОRCH-синдром, или TОRCH-инфекции, – это обобщенное название, используемое для обозначения группы внутриутробных инфекций (ВУИ). В основе термина, который предложил Andre J. Nahmias в 1971 г., лежит сокращение (по первым буквам) латинских названий наиболее часто верифицируемых врожденных инфекций:
T – токсоплазмоз (Тoxoplasmоsis)
О – другие инфекции (Оther)
R – краснуха (Rubella)
С – цитомегалия (Cytomegalia)
Н – инфекции, вызванные вирусом простого герпеса (Herpes).
В отечественной педиатрической практике наиболее часто используют термин «внутриутробные инфекции», что является синонимом термина «TОRCH-инфекции».
ВУИ – инфекционно-воспалительные заболевания плода и новорожденного. Несмотря на то, что ВУИ имеют различную этиологию, их объединяют общие эпидемиологические закономерности и сходные клинические проявления [1–3, 7–9]. ВУИ возникают в результате анте- или интранатального инфицирования плода.
ВУИ считаются одной из наиболее острых проблем современной медицины, решение которой возможно только при междисциплинарном подходе и совместной работе специалистов-медиков различных профилей (акушеры-гинекологи, инфекционисты, неонатологи, педиатры, эпидемиологи). Актуальность ВУИ обусловлена целым рядом факторов, главными среди которых являются:
– широкая распространенность потенциальных возбудителей среди всех групп населения;
– бессимптомное течение или отсутствие патогномоничных клинических симптомов;
– высокий риск развития патологии у плода или новорожденного при первичном инфицировании женщины во время беременности;
– возможность обострения латентной инфекции у иммунокомпрометированных женщин во время беременности с потенциальным риском внутриутробного заражения плода;
– существенное место ВУИ в структуре неблагоприятных исходов беременности (выкидыши, мертворождение, преждевременные роды);
– тератогенное влияние возбудителей ВУИ на эмбриогенез и ранний фетогенез, приводящее к развитию у плода врожденных пороков. Неблагоприятное влияние внутриутробного инфекционно-воспалительного процесса с поражением ЦНС, сердца, печени, почек и других органов и систем;
– высокий уровень летальности среди новорожденных и грудных детей с манифестными формами ВУИ;
– неблагоприятное воздействие ВУИ на состояние здоровья детей в последующие периоды постнатального развития, в ряде случаев приводящее к инвалидизации и снижению качества жизни в целом.
Истинная частота врожденных инфекций до настоящего времени не установлена, хотя, по данным ряда авторов, распространенность внутриутробного инфицирования в некоторых случаях может достигать 10–15%.
ВУИ во многом определяют уровень перинатальной и младенческой смертности, а также инвалидизацию выживших детей. В подавляющем большинстве случаев источником инфекции для плода является мать. Механизм передачи инфекции – вертикальный. В антенатальный период передача инфекции может происходить трансовариальным, трансплацентарным и восходящим путями, в интранатальный период – контактным, алиментарным. Ятрогенное инфицирование плода встречается крайне редко и только в тех случаях, когда нарушены правила асептики при проведении инвазивных методов пренатальной диагностики (амниоцентез, кордоцентез и др.) и лечения (введение лекарственных средств и препаратов крови через сосуды пуповины и др.) [2, 5, 8, 9].
При антенатальном инфицировании этиология ВУИ представлена, как правило, различными вирусами (цитомегаловирус, вирус краснухи, Коксаки и ЕСНО-вирусы и др.), токсоплазмой и микоплазмой. Интранатальное заражение характеризуется более широким спектром возбудителей и зависит от особенностей микробного пейзажа слизистых оболочек родовых путей матери. Наиболее часто в этот период происходит инфицирование плода такими микроорганизмами, как стрептококки группы В, различные энтеробактерии, стафилококки, герпес-вирусы, ВИЧ, микоплазмы, уреаплазмы, хламидии, грибы и др.
Помимо «классических» возбудителей TОRCH-инфекции установлено патогенное влияние на плод энтеровирусов, ВИЧ, хламидий (Chlamydia trachomatis), микоплазм (Mycoplasma hominis, Mycoplasma genitalium), уреаплазмы (Ureaplasma urealyticum), вирусов гриппа, парагриппа, аденовирусов, парвовируса B19, вирусов герпеса человека 4 и 6 типов и других микроорганизмов [1, 7–9, 11].
Фактором риска внутриутробного инфицирования плода является отягощенный соматический, акушерско-гинекологический и инфекционный анамнез. При этом риск инфицирования значительно повышается при воспалительных заболеваниях урогенитального тракта, неблагоприятном течении беременности (инфекционные заболевания, тяжелый гестоз, угроза прерывания, патологическое состояние маточно-плацентарного барьера) и патологических родах.
Прогноз при ВУИ зависит от срока гестации, в котором произошло инфицирование, особенностей возбудителя (патогенные свойства, тропность и т. д.), функционального состояния иммунной системы матери, состояния маточно-плацентарного барьера и др. Наиболее часто инфицирование плода и развитие тяжелых форм ВУИ отмечают в тех случаях, когда во время беременности женщина переносит первичную инфекцию.
Инфицирование в период эмбриогенеза приводит к самопроизвольному выкидышу или возникновению тяжелых, несовместимых с жизнью пороков развития (табл. 1). Проникновение возбудителя в организм плода в ранний фетальный период ведет к развитию инфекционно-воспалительного процесса, который характеризуют преобладание альтернативного компонента и формирование в поврежденных органах фиброзно-склеротических деформаций. Инфицирование плода в поздний фетальный период может приводить как к поражению отдельных органов и систем, так и к генерализованному воспалению (гепатит, кардит, менингоэнцефалит, хориоретинит, поражение органов кроветворения и др.) (табл. 1). При интранатальном инфицировании клиническая манифестация ВУИ в подавляющем большинстве случаев происходит в ранний неонатальный период, но может отмечаться и в последующие недели жизни.
В МКБ-10 ВУИ представлены в классе XVI «Отдельные состояния, возникающие в перинатальном периоде» в блоках Р35–Р39 «Инфекционные болезни, специфичные для перинатального периода». В зависимости от этиологии выделяют ВУИ вирусного, бактериального и паразитарного генеза (табл. 2).
Клинические проявления TОRCH-синдрома в подавляющем большинстве случаев зависят не только от этиологии, но и от сроков беременности, когда произошло инфицирование. Манифестные формы ВУИ у новорожденных имеют сходные клинические проявления. При этом очень часто дети рождаются раньше срока или с признаками задержки внутриутробного развития, гепатоспленомегалией. Нередко у детей с ВУИ отмечаются желтуха, экзантемы, дыхательные и разнообразные неврологические нарушения, геморрагические синдромы, анемия (рис. 1). При этом необходимо особо подчеркнуть крайне низкую достоверность диагноза, если используется анализ только клинических особенностей заболевания. В то же время достоверную верификацию этиологии ВУИ следует провести как можно раньше, учитывая, что в настоящее время возможно применение эффективных этиотропных лекарственных препаратов для целого ряда ВУИ (ацикловир – при врожденном герпесе, бензилпенициллин – при врожденных сифилисе и стрептококковой В инфекции, ампициллин – при врожденном листериозе, макролиды – при внутриутробных микоплазмозе, хламидиозе и уреаплазмозе, пириметамин + сульфаниламид или спирамицин – при врожденном токсоплазмозе и др.).
Лабораторная верификация этиологии TОRCH-синдрома является ключевым звеном диагностики и определяет возможность своевременного назначения специфической терапии. При этом однотипность клинических проявлений ВУИ обосновывает необходимость безотлагательного проведения лабораторной расшифровки этиологии заболевания. Для этиологической верификации врожденных инфекций используют 2 основные группы методов, условно обозначаемых как «прямые» и «непрямые».
К «прямым» лабораторным тестам относятся методы, направленные на обнаружение самого возбудителя (классические микробиологические, вирусологические), его ДНК или РНК (молекулярно-биологические) или антигенов (иммунохимические). «Непрямые» тесты – методы, позволяющие обнаружить в сыворотке крови пациента специфические антитела к антигенам возбудителя. В последние годы для этого наиболее часто используют иммуноферментный анализ (ИФА).
«Золотым стандартом» лабораторной диагностики ВУИ считается комбинация «прямых» и «непрямых» методов диагностики, что позволяет существенно повысить диагностические возможности лабораторной верификации этиологии ВУИ. При этом наиболее часто из «прямых» методов используют полимеразную цепную реакцию (ПЦР) (специфичность и чувствительность – более 90%), а из «непрямых» – ИФА (специфичность и чувствительность – более 75%) [2, 5, 8–15].
Применяя ПЦР, целесообразно использовать современные методики количественного определения ДНК или РНК инфекционных агентов, основанные на амплификации с гибридизационно-флуоресцентной детекцией продуктов анализа в режиме реального времени, а также параллельно тестировать несколько биологических сред (кровь, спинномозговая жидкость, моча, назофарингеальные мазки, эндотрахеальные аспираты и др.). Подобный подход достоверно увеличивает клиническую информативность проводимых исследований, позволяет оценить динамику развития инфекционного процесса и эффективность этиотропной терапии.
ИФА должен проводиться до введения плазмы и иммуноглобулинов. При этом диагностическое значение ИФА существенно повышается, если обследование новорожденного проводится одновременно с обследованием матери с обязательным определением индекса авидности специфических IgG. Использование «парных сывороток» для определения нарастания концентрации антител в динамике возможно только в тех случаях, если новорожденный не получал препаратов крови (плазмы, иммуноглобулинов и др.) [2, 8, 10].
Критериями верификации этиологии ВУИ является выявление у новорожденного ребенка специфических IgM и/или генома (ДНК, РНК) возбудителя. Косвенным лабораторным признаком ВУИ определенной этиологии является детекция специфических IgG c низким индексом авидности при отсутствии специфических IgM (рис. 2). Диагностическое значение низкоавидных специфических IgG существенно повышается, если при параллельном серологическом обследовании матери у нее выявляют высокоавидные специфические IgG [2, 5, 8, 10].
Таким образом, в настоящее время имеются высокочувствительные и высокоспецифичные методы лабораторной диагностики, которые позволяют быстро и с высокой степенью достоверности верифицировать этиологию заболевания, что определяет возможность раннего начала этиотропной терапии для улучшения прогноза ВУИ.
- Врожденные, перинатальные и неонатальные инфекции: пер. с англ. / под ред. А. Гриноу, Дж. Осборна, Ш. Сазерленд. М.: Медицина, 2000.
- Заплатников А.Л., Коровина Н.А., Корнева М.Ю., Чебуркин А.В. Внутриутробные инфекции: диагностика, лечение, профилактика // Лечащий врач. 2005. №8. С. 54–62.
- Учайкин В.Ф., Нисевич Н.И., Шамшева О.В. Инфекционные болезни у детей. М.: ГЭОТАР-Медиа, 2013. 688 с.
- Ивановская Т.Е., Леонова Л.В. Патологическая анатомия болезней плода и ребенка. М.: Медицина, 1989.
- Протоколы диагностики, лечения и профилактики внутриутробных инфекций у новорожденных детей Российской ассоциации перинатологов (методические рекомендации). М.: ГОУ ВУНМЦ МЗ РФ, 2001.
- Цинзерлинг В.А., Мельникова В.Ф. Перинатальные инфекции. Вопросы патогенеза, морфологической диагностики и клинико-морфологических сопоставлений. Руководство для врачей. СПб.: Элби-СПб, 2002.
- Шабалов Н.П. Неонатология. СПб., 2006.
- Дегтярев Д.Н., Заплатников А.Л. Внутриутробные инфекции. В кн: Неонатология. Национальное руководство. Краткое издание / под ред. акад. РАМН Н.Н. Володина. М.: ГЭОТАР-Медиа, 2013. С. 725–729.
- Red Book: Report of the Committee on Infectious Diseases. 29h ed. Elk Grove Village, IL: American Academy of Pediatrics, 2010. Р. 964.
- Заплатников А.Л. Специфическая иммунотерапия внутриутробной цитомегаловирусной инфекции. В кн.: Иммуноглобулины для внутривенного введения в педиатрической практике / под ред. Н.А. Коровиной, А.Л. Заплатникова. М., 2008. С. 42–58.
- Nandyal R.R. Update on group B streptococcal infections: perinatal and neonatal periods // J Perinat Neonatal Nurs. 2008. Vol. 22 (3). Р. 230–237.
- Шипулина О.Ю., Пиксасова О.В., Садова Н.В. и др. Значение молекулярно-биологических методов в диагностике листериоза беременных и новорожденных. М., 2008.
- Сафонова А.П., Пиксасова О.В., Скачкова Т.С. и др. Разработка методики выявления и количественного определения ДНК Streptococcus agalactiae на основе ПЦР в режиме реального времени: Материалы II Ежегодного Всероссийского конгресса по инфекционным болезням. М., 2010. С. 282.
- Principles and Practice of Infectious Diseases / Ed. Mandell G.L., Bennett J.E., Dolin R. Seventh Edition. New York.: Mandell, Douglas and Bennett’s, 2010. Р. 876.
- Textbook of Pediatric Infectious Diseases / Ed. J.D.Cherry, Seventh Edition, New York – London: Feigin and Cherry’s, 2009. Р. 265.
Только для зарегистрированных пользователей
источник
Многие женщины во время беременности, при регулярном визите к гинекологу, встречаются с таинственным термином TORCH. Анализ крови на ТОРЧ инфекции — это фраза, которую часто используют врачи. Эта аббревиатура образована из первых букв названий возбудителей инфекционных заболеваний.
Инфекция ТОРЧ вызывает следующие болезни:
- токсоплазмоз (T. Гонди);
- коревой (вирус краснухи);
- цитомегаловирус;
- герпетические инфекции (исследование крови на герпес);
- идругиеинфекции, такиекаксифилис, листериоз, гепатит С или ВИЧ.
Группа этих заболеваний может стать серьезной проблемой, если они появляются во время беременности, поэтому так важно регулярно проходить медицинский осмотр и сдавать анализы для их обнаружения, что позволяет пройти лечение на ранней стадии заболевания.
Частота специфических заболеваний различна, но чаще они выявляются при рекомендованных исследованиях в ходе беременности.
Эти данные указывают на то, что например, герпес встречаются у новорожденных 0,02-0,013%, цитомегаловирусная инфекция появляется в 1-4% беременных женщин и менее 50% женщин подвержены риску заражения токсоплазмозом.
Введение обязательной вакцинации в мировой практике значительно снизило заболеваемость корью и возможные ее осложнения. В последние несколько лет были зарегистрированы врожденные формы этого заболевания, хотя результаты анализа крови сообщают, что более 10% женщин в репродуктивном возрасте не имеет защитных антител.
Заболеваемость сифилисом, листериозом или корью колеблется от менее одного до нескольких случаев на 100 000 взрослых.
Некоторые из этих болезней представляют собой характерную клиническую картину, которая, вместе с эпидемиологической историей, позволяет поставить правильный диагноз.
В большинстве случаев должны быть проведены лабораторные испытания и сделана правильная и полная расшифровка анализа крови на ТОРЧ инфекции. Важную роль играют серологическое исследование на ТОРЧ, включая идентификацию соответствующих классов антител и молекулярные тесты, позволяющие обнаружить наличие генетического материала возбудителя (возбудителя заболевания) и, таким образом, бесспорно подтвердить или исключить инфекцию.
Тестирование крови на патогены TORCH должно быть сделано в первом триместре беременности. Наиболее удобно выполнить тест на стадии подготовки к беременности, это позволит наилучшим образом отслеживать возможные инфекции. Рекомендации Министерства здравоохранения, в частности, относятся к варианту тестирования на 10-й недели беременности для выявления сифилиса, токсоплазмоза, краснухи, вируса гепатита С (ВГС) и исследование крови на ВИЧ-инфекции.
Дальнейшие рекомендации относятся к беременным женщинам, у которых результаты исследований на токсоплазмоз, выполненные в первом триместре беременности, не выявили наличие заболевания (они были отрицательными). Анализ крови на ТОРЧ инфекции при беременности также должен проводиться между 21 и 26 неделями беременности. Повторная диагностика рекомендуется от 33 до 37 недель беременности на наличие заболеваний гепатита В (HBV) и С (ВГС), ВИЧ и сифилиса. Чрезвычайно важным является диагностика цитомегаловирусной инфекции с первого триместра беременности.
Полученные результаты, указывающие на возможную инфекцию требует дополнительного изучения и определения места, в котором произошла инфекция. Исследования включают в себя показатель авидности IgG (авидность — способность быстро реагировать на атакующей патоген), который говорит нам о степени поражения инфекцией (авидность увеличивается со временем).
Более подробная информация также можно получить определив уровень антител в крови, но часто наиболее важными являются молекулярные тесты из образца амниотической жидкости, крови или мочи, генетического материала возбудителя. Например, двухтрековая идентификация патогена цитомегаловируса. Мы ищем появления клинических симптомов инфекции или двусмысленность скрининга серологических тестов. Диагноз возможен после определения IgG и IgM и выделения вируса в моче, слюне и амниотической жидкости, полученной во время амниоцентеза.
В случае краснухи, защитные антитела получают после вакцинации или после болезни. Если их уровень низок, организм пациента не защищен от заболевания. Поэтому важным показателем является уровень защитных антител, который будет определять потенциальный риск заболевания.
Многие мамы задаются вопросом: как берут кровь у грудничка на торч инфекции. Это практически безболезненная манипуляция, на пяточке ребенка делают маленький прокол и берут кровь для анализа. Так, что нет поводов для беспокойства.
Возможные осложнения включают врожденный токсоплазмоз. Дефекты нервной системы, потеря слуха, нарушение зрения. При тяжелых формах инфекции могут иметь место выкидыши, мертворождения или осложнения в органах. Раннее обнаружение токсоплазмозом во время беременности может значительно сократить лечение и риск осложнений, которые наблюдаются у детей, рожденных от матерей, прошедших лечение.
Краснуха может бессимптомно протекать у беременных женщин, в то время, как плод может быть подвержен высокому риску серьезных осложнений — от абортов до многочисленных врожденных дефектов. Риск осложнений под влиянием времени инфицирования обратно пропорционален продолжительности беременности. В первом триместре беременности наибольшая степень риска, а наименьшая в третьем.
Среди наиболее распространенных осложнений кори являются:
Риск инфицирования плода при заражении цитомегаловирусом существует в каждом триместре беременности, хотя большая часть ущерба он наносит на ранней стадии беременности.
К сожалению, присутствие материнских антител против этого вируса не обеспечивает защиту от инфекции. Некоторые из симптомов врожденного цитомегаловируса могут быть видны на УЗИ — ультразвуковом исследовании (ретинит, глухота, нарушение психомоторного развития ребенка).
Инфекция после родов у новорожденного также связано с риском осложнений со смертельным исходом в 10% случаев. Изолированные два типа вируса простого герпеса HSV-1 и HSV-2.
Практически все из них нападают на отдельные части тела, HSV-1 поражает преимущественно кожу и слизистую оболочку полости рта, в то время как HSV-2 поражает кожу и слизистую оболочку половых органов мужчин и женщин. Во время первичной ТОРЧ инфекции вирус может атаковать плод. Внутриутробное инфицирование в 25% приводит к выкидышу или преждевременным родам. В других случаях, могут быть отклонения в развитии у детей.

При генитальном герпесе, повышается риск инфицирования новорожденного во время родов. В этом случае, самый безопасный способ прерывания беременности — кесарево сечение. Во время ухода за ребенком и кормления грудью очень важно соблюдать правила гигиены как при активной форме орального герпеса, так и при герпесе половых органов. Вирус может легко инфицировать ребенка. Поэтому анализ крови на ТОРЧ инфекции у ребенка делают в первые дни жизни.
Грипп распространенное заболевание, в том числе и у беременных женщин. Хотя в настоящее время и установлено, что грипп не увеличивает риск выкидыша, врожденных дефектов или внутриутробной смерти, все же существует риск преждевременных родов во время заболевания верхних дыхательных путей. Поэтому рекомендуются прививки также во время беременности и кормления грудью.
Прививки против кори во время беременности связаны с высокой частотой выкидышей, преждевременными родами и серьезными осложнениями для женщин, таких как: тяжелая пневмония, поражение сердечной мышцы, мозга и печени.
Врожденное заболевание может привести к смерти новорожденного до 60% случаев. Благодаря вакцинации в детском возрасте от краснухи и кори, у беременных женщин увеличивается устойчивость к данным заболеваниям.
Энтеровирусы являются более широкой группой и включают вирусы: Coxackie или вирус полиомиелита, вызывающих гепатит А. Заболевания, вызванные этими вирусами являются типичными «болезнь грязных рук». К сожалению, в то время как последствия для пациента невелики, для будущего ребенка могут быть очень серьезными, в том числе и внутриутробная смерть плода. Поэтому очень важно соблюдать основные правила гигиены.
Как вы можете ясно видеть, эти болезни часто могут представлять серьезную опасность для матери и ее ребенка. Чтобы свести к минимуму риск осложнений необходимо своевременно реагировать путем проведения диагностических тестов и анализа крови на ТОРЧ инфекции.
источник
ТОРЧ инфекции при беременности относятся к внутриутробным инфекциям. К врожденным инфекциям приковано большое внимание медиков, поскольку младенческая смертность во многом обязана именно им (до 25% смертей).
По статистике почти 80% врожденных пороков развития относятся к проблеме трансплацентарного инфицирования плода. Более того, около 30% таких детей умирают в возрасте до года.
Внутриутробные инфекции исследовались давно, но только в 1971 году ВОЗ свел воедино наиболее часто встречаемые и назвал этот список TORCH синдром.
Внимание. Чаще всего источником инфекции для плода является мать. Однако за последние годы отмечается, что пренатальная диагностика (инвазивные методы), а также некоторые методы лечения (пунктирование сосудов пуповины, амниоцентез) могут способствовать ятрогенному внутриутробному инфицированию плода.
ТОРЧ инфекции – это медицинская аббревиатура, состоящая из первых букв инфекционных патологий, которые могут передаваться плоду от женщины, вынашивающей ребенка (группа перинатальных инфекций).
Согласно официальной статистике Всемирной организации здоровья (ВОЗ), ТОРЧ-инфекции являются причиной около 5% всех врожденных патологий развития у новорожденных во всем мире. Хотя по некоторым источникам эта цифра может доходить до 10-15%%.
В список основных ТОРЧ-инфекций (TORCH или TORCHS инфекции) входят:
- Т — токсоплазменные инфекции;
- О — другие, инфекции, включающие микоплазму, сифилис, гонорею, хламидийные инфекции, гепатит, стрептококковые инфекции, кандидозные инфекции, а также прочие заболевания вирусной или бактериальной этиологии;
- R — краснуха;
- C — цитомегаловирусную инфекцию;
- H — другие герпетические инфекции.
Особенностью ТОРЧ инфекций является то, что большинство из них (ветряная оспа, краснуха) чаще всего, легко переносятся как взрослыми, так и детьми. Заболевания обычно протекают легко и редко сопровождаются развитием осложнений.
Внимание. Однако, ТОРЧ инфекции при беременности, даже протекая легко для самой беременной, представляют высочайшую степень угрозы для будущего ребенка.
Эти инфекции могут приводить к:
- внутриутробной гибели ребенка,
- развитию внутриутробных инфекционных патологий и аномалий формирования плода.
Риск для плода зависит от типа ТОРЧ, срока инфицирования беременной, а также от того, было ли назначено своевременное лечение (при большинстве инфекций при вовремя начатой терапии риск поражения плода сводится к минимуму).
Справочно. В связи с этим, анализ на ТОРЧ-инфекции относится к важнейшему типу исследований, проводимых во время беременности.
В идеале, исследование должно проводиться еще на этапе планирования беременности. Особую важность данное исследование имеет для женщин, не знающих, болели ли они в детском возрасте ветрянкой и краснухой, или нет.
В случаях, если у женщины, планирующей беременность, отсутствуют иммуноглобулины к возбудителю краснухи или ветряной оспы, ей может быть рекомендована вакцинация от данных заболеваний (при этом рекомендовано на протяжении не менее трех месяцев после вакцинации использовать барьерные методы контрацепции).
Анализ на ТОРЧ-инфекцию при беременности проводится для определения уровней Ig класса М и G к основным типам инфекций, передающихся внутриутробно.
Высокий уровень Ig класса М свидетельствует об остром инфицировании или о недавно перенесенной инфекции.
При выявлении Ig класса G речь идет о перенесенной ранее инфекции (в случае с ветряной оспой и краснухой – о наличии иммунитета к данным инфекциям). При значительном уровне повышения Ig G говорят о рецидиве ранее перенесенной инфекции.
Во время планирования беременности более важно выявление иммуноглобулинов класса G (определение иммунитета), так как большая ТОРЧ для плода максимально опасна именно при первичном заражении матери (при рецидивах ранее перенесенной инфекции, риск поражения плода ниже).
Классический анализ включает в себя:
- Anti-CMV-Ig G и M (определение антител G и M к цитомегаловирусной инфекции);
- Anti-HSV-Ig G и М (определение антител G и М к герпесу 1 и 2 типов);
- Anti-Rubella-Ig G и M (определение антител G и M к вирусу краснухи);
- Anti-Toxo-Ig G и M (определение антител G и M к токсоплазме).
Дополнительно, по показаниям, врач может назначить исследование на антитела к ветряной оспе, анализы на гепатит, гонорею, сифилис, хламидийную инфекцию и т.д.
При заражении на ранних сроках, чаще всего, отмечается внутриутробная гибель плода.
При контакте с инфекцией на более поздних сроках преимущественно отмечается развитие внутриутробного инфицирования и аномалий формированя плода различной степени тяжести.
Справочно. Инфицирование токсоплазмозом на раннем сроке чаще всего приводит к замиранию беременности и выкидышу. Врожденный токсоплазмоз у детей проявляется тяжелым поражением глаз (врожденные формы катаракты, глаукомы, атрофии зрительных нервов), поражением головного мозга (его недоразвитие, кисты).
Также могут отмечаться гепатиты, менингоэнцефалиты, генерализованное поражение внутренних органов.
Герпетическая инфекция 1 и 2 типа приводит к внутриутробному поражению нервной системы плода, поражению органов ЖКТ, развитием некротической сыпи у новорожденных, тяжелой герпетической пневмонии, развитию тромбоцитопении и кровотечениям (вплоть до ДВС-синдрома), развитию сепсиса.
Цитомегаловирусная инфекция сопровождается тяжелым внутриутробным поражением головного мозга и глаз плода, развитием гепатитов, пневмоний и кардитов у новорожденных.
Врожденная краснуха приводит к тяжелому поражению сердечно-сосудистой системы (врожденные пороки сердца), развитию врожденной глухоты и пороков глаз.
Микоплазменная инфекция у новорожденных чаще всего приводит к развитию тяжелых пневмоний.
Хламидийные инфекции сопровождаются развитием пневмоний, вульвитов, уретритов, проктитов, конъюнктивитов, назофарингитов и т.д.
Анализ крови на ТОРЧ-инфекции рекомендовано сдавать еще на этапе планирования. При выявлении у пациентки иммуноглобулинов М (показатель острой инфекции) или высоких титров иммуноглобулинов G (свидетельствует о рецидиве ранее перенесенной инфекции) назначается лечение, а затем, после его окончания обязательно проводится повторный анализ.
При отсутствии у пациентки Ig G к ветряной оспе и краснухе может быть рекомендована вакцинация (в таком случае, планируемая беременность допускается не ранее, чем через три месяца после проведения вакцинации).
Провести обследование плода на ТОРЧ крайне затруднительно. Потому, обследование на ТОРЧ проходит беременная, особенно, данное обследование важно для женщин из групп риска.
Во время вынашивания ребенка анализ крови на ТОРЧ-инфекции показан:
- при постановке женщины на учет (первый анализ желательно выполнить на сроке до 15 недель);
- на строке с 24 по 26 недели;
- с 34 по 36 неделю.
Также гемотест на ТОРЧ-инфекцию обязателен перед проведением процедуры ЭКО.
Дополнительно проводится обязательное ультразвуковое исследование плода.
Анализ на ТОРЧ назначается врачом из женской консультации или гинекологом (репродуктологом), у которого наблюдается женщина, планирующая беременность.
В классическое исследование на ТОРЧ входит анализ на антитела к токсоплазмам, вирусу краснухи, а также вирусам простого герпеса (1 и 2 тип) и цитомегаловирусной инфекции.
При необходимости, врач назначает дополнительные анализы на гонорею, сифилис, ветряную оспу, хламидийную инфекцию, микоплазму и т.д.
Расшифровкой анализов на ТОРЧ-инфекцию занимается лечащий врач, выдавший направление на исследование. Самостоятельная трактовка результатов и самостоятельное назначение лечения недопустимы.
Специфической подготовки к анализу не требуется. Кровь сдается утром натощак. Для анализа используется венозная кровь.
Трактовка анализов включает в себя оценку уровней иммуноглобулинов класса М и G к возбудителям ТОРЧ-инфекций.
Об остром инфицировании свидетельствует выявление иммуноглобулинов М, а о рецидиве ранее перенесенной инфекции – увеличение уровня иммуноглобулинов G.
При повышении уровня иммуноглобулинов G риск поражения плода ниже, чем при высоком уровне иммуноглобулинов М.
| Класс антител | Концентрация | Ед. изм. | |
| 1 | lgА | 0,35-3,55 | г/л |
| 2 | lgG | 7,8-18,5 | г/л |
| 3 | lgM | 0,8-2,9 | г/л |
Следует отметить, что по отдельности результаты исследований не трактуются. Уровень иммуноглобулинов М должен всегда оцениваться в комплексе с уровнем иммуноглобулинов G.
При оценке уровней иммуноглобулинов М к токсоплазмозу проводится качественный анализ. То есть, оцениваются не титры иммуноглобулинов, а только их присутствие.
- Положительный. Такой результат свидетельствует об острой инфекции. У новорожденных детей иммуноглобулин М к токсоплазмозу свидетельствует о внутриутробном инфицировании и врожденном токсоплазмозе.
- Отрицательный. Свидетельствует об отсутствии инфицирования или о том, что заражение произошло более 3 недель назад (в таком случае регистрируются иммуноглобулины G). При отсутствии у новорожденного иммуноглобулинов М диагноз врожденного токсоплазмоза исключается.
При очень низких уровнях иммуноглобулинов М может выставляться сомнительный результат. В таком случае, анализ требуется повторить через 10-14 дней.
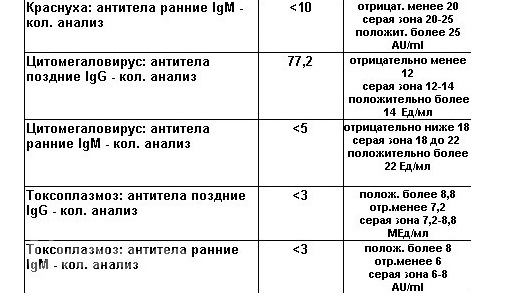
Анализ на иммуноглобулины G – качественный. Исследование определяет увеличение уровня титров антител к возбудителю токсоплазмоза. Результаты исследования записываются в ЕД/мл:
- менее 1.6 – отрицательный результат (свидетельствует о полном отсутствии иммунитета к токсоплазмозу);
- от 1.6 до 2.9 – сомнительные результаты (свидетельствуют о недостаточном уровне иммунитета);
- более 3 – положительный результат, свидетельствующий об иммунитете к токсоплазмозу.
При увеличении уровня антител более чем на 30-40% выставляют диагноз рецидива инфекции.
Внимание. Следует отметить, то отрицательный и сомнительный результат может также регистрироваться в первые недели заражения (в таком случае, регистрируют высокий уровень иммуноглобулина М).
Для определения иммуноглобулинов М к краснухе используют качественные тесты. Стоит учесть, что анализ на краснуху при беременности делать надо, хотя вроде бы заболевание не так опасно.
При обнаружении иммуноглобулинов М выставляется диагноз острой инфекции. У беременных такой результат говорит о внутриутробном инфицировании плода.
Выявление отрицательных результатов свидетельствует об отсутствии инфекции. Также такие результаты могут наблюдаться при слишком раннем или позднем (не исключается недавно перенесенная инфекция) взятии анализа.
При получении сомнительных результатов анализ повторяют через 10-14 дней.
При оценке уровней иммуноглобулинов G результаты записываются в ЕД/мл:
- менее 5 – отрицательный результат (отсутствует иммунитет к краснухе);
- от 5 до 9.9 – сомнительные результаты (рекомендовано повторить исследование через 10-14 дней);
- более 10 – положительный результат (у пациентки есть иммунитет к краснухе).
При исследовании уровня иммуноглобулинов М оценивают степень их повышения:
- титры менее 0.8 – отрицательные результаты;
- от 0.8 до 1.1 – сомнительные результаты (анализ повторяют через 7-10 дней);
- более 1.1 – положительные результаты, свидетельствующие об острой герпетической инфекции (реже о реактивации хронической инфекции).
Отрицательные результаты свидетельствуют о хронической инфекции или об отсутствии инфицирования.
При оценивании уровней иммуноглобулинов G результаты могут быть положительными (при умеренном повышении – носительство инфекции, при высоком уровне – реактивация инфекции) или отрицательными (полное отсутствие антител).
Получение положительных результатов иммуноглобулинов М на цитомегаловирусную инфекцию свидетельствует об остром инфицировании и возможном внутриутробном заражении плода у беременных.
При получении сомнительных результатов анализ необходимо повторить через 10-14 дней.
Отрицательные результаты свидетельствуют об отсутствии острой инфекции. Также не исключается, что заражение произошло более 3-4 недель до исследования. Поражение плода при таких результатах маловероятно.
При исследовании уровня иммуноглобулинов G, нормальным считаются результаты от 0 до 6 ЕД/мл. Повышение уровня антител свидетельствует о реактивации цитомегаловируса и возможном поражении плода.
Признаками внутриутробного инфицирования плода могут быть:
- • недоношенность;
- • недостаточная масса тела;
- • развитие в первые дни жизни пневмонии, уретритов, герпетических высыпаний, конъюнктивитов, назофарингитов;
- • врожденные пороки сердца;
- • врожденные пороки глаз;
- • врожденная глухота;
- • тяжелая желтуха новорожденных;
- • лихорадка и интоксикация;
- • отеки;
- • судороги и тремор конечностей;
- • одышка;
- • цианоз;
- • маленький размер головы;
- • заторможенность ребенка, отсутствие рефлексов.
Внимание. При подозрении на внутриутробное поражение, ребенку назначают анализы на краснуху, токсоплазмоз, цитомегаловирус.
источник
Внутриутробные инфекции ( ВУИ , врождённые инфекции, TORCH-синдром) — группа инфекционно-воспалительных заболеваний плода и новорождённого, вызванных различными возбудителями, но характеризующихся общими эпидемиологическими закономерностями и нередко имеющими сходные клинические проявления. Для обозначения внутриутробных инфекций, манифестирующих с первого дня жизни, используют также термин «TORCH-синдром». Данный термин образован первыми буквами латинских названий наиболее часто верифицируемых врождённых инфекций: T — токсоплазмоз (Тoxoplasmоsis), R — краснуха (Rubella), С — цитомегалия (Cytomegalia), Н — герпес (Herpes) и О — другие инфекции (Оther). К последним относят сифилис, листериоз, вирусные гепатиты, хламидиоз, ВИЧ-инфекция, микоплазмоз и др. Врождённые инфекции возникают в результате внутриутробного (антенатального или интранатального) инфицирования плода. При этом в большинстве случаев источником инфекции для плода является мать. В последние годы использование инвазивных методов пренатальной диагностики и лечения (амниоцентез, пунктирование сосудов пуповины и др.) и внутриматочное введение препаратов крови через сосуды пуповины (переливание эритроцитарной массы плоду при гемолитической болезни), а также пролонгирование беременности при преждевременном разрыве околоплодных оболочек предрасполагают к ятрогенному внутриутробному инфицированию плода.
Истинная частота врождённых инфекций до настоящего времени не установлена, однако по данным ряда авторов распространённость внутриутробного инфицирования в человеческой популяции может достигать 10–15%. ВУИ относят к тяжёлым заболеваниям, которые во многом определяют уровень младенческой смертности. При этом актуальность проблемы ВУИ обусловлена не только существенными перинатальными и постнатальными потерями, но и нередким возникновением неблагоприятных отдалённых последствий для здоровья, приводящих к инвалидности у детей, перенёсших тяжёлые формы врождённой инфекции.
Основным источником инфекции при ВУИ является мать ребёнка, от которой возбудитель в антенатальном или интранатальном периоде проникает в организм плода. При этом вертикальная передача инфекции может быть осуществлена трансовариальным, трансплацентарным и восходящим путями в антенатальный период, а также контактным путём во время родов. Антенатальное инфицирование в большей степени характерно для вирусов (ЦМВ, вирус краснухи, Коксаки и др.), токсоплазмы и микоплазмы. Интранатальная контаминация более характерна для бактерий и грибов. При этом спектр возбудителей интранатальной инфекции значительно разнообразней и зависит от особенностей микробного пейзажа слизистых оболочек родовых путей матери. Наиболее часто в этот период происходит инфицирование плода такими микроорганизмами, как стрептококки группы В, энтеробактерии, эшерихии коли, а также вирусы простого герпеса, ВИЧ, микоплазмы, уреаплазмы, хламидии и др. В настоящее время известно более 100 микроорганизмов, способных вызывать ВУИ . Помимо «классических» возбудителей TORCH-инфекции, показано патогенное влияние на человеческий плод энтеровирусов, ВИЧ, хламидий, микоплазмы (Ureaplasma urealyticum, Mycoplasma hominis), вирусов гриппа, парагриппа, аденовирусов, парвовирусов B16, герпес-вирусов 4 и 6 типов и др.
При высокой распространённости внутриутробного инфицирования потенциальная угроза внутриутробной трансмиссии инфекционных агентов от матери к ребёнку существенно возрастает в тех случаях, когда женщина имеет отягощённый соматический, акушерско-гинекологический и инфекционный анамнез. При этом риск инфицирования повышают воспалительные заболевания урогенитального тракта, неблагоприятное течение беременности (тяжёлые гестозы, угроза прерывания, патологическое состояние маточно-плацентарного барьера, инфекционные заболевания). Развитие манифестных форм инфекционного заболевания во многом зависит и от состояния новорождённого. Так, риск реализации врождённой инфекции значительно возрастает при недоношенности; задержке пренатального развития; перинатальном поражении ЦНС; патологическом течении интранатального или раннего неонатального периода.
Помимо этого, прогноз внутриутробной инфекции зависит от срока гестации, в котором произошло инфицирование, особенностей возбудителя (патогенных и иммуногенных его свойств), длительности течения инфекции у матери (первичная или вторичная), функционального состояния иммунной системы матери, целостности маточно-плацентарного барьера и др.
Инфекция называется первичной в том случае, если организм матери инфицируется данным возбудителем впервые во время беременности. О первичном характере инфекции можно говорить, если специфические АТ (IgМ, IgG) обнаруживают у ранее серонегативного пациента. Если же инфекционный процесс развивается в результате активизации возбудителя, находившегося до этого в организме в латентном состоянии (реактивация), или из-за повторного инфицирования (реинфекция), то такую инфекцию классифицируют как вторичную. Наиболее часто инфицирование плода и развитие тяжёлых форм ВУИ отмечают в тех случаях, когда во время беременности женщина переносит первичную инфекцию.
В тех случаях, когда инфицирование происходит в период эмбриогенеза, чаще отмечаются самопроизвольные выкидыши или возникают тяжёлые, несовместимые с жизнью пороки развития. Проникновение возбудителя в организм плода в ранний фетальный период приводит к развитию инфекционно-воспалительного процесса, который характеризует преобладание альтернативного компонента и формирование в повреждённых органах фиброзно-склеротических деформаций. При этом нередко возникает первичная плацентарная недостаточность, сопровождающаяся хронической внутриутробной гипоксией плода и развитием симметричной ЗВУР. Инфицирование плода в поздний фетальный период сопровождает как воспалительное повреждение отдельных органов и систем (гепатит, кардит, менингит или менингоэнцефалит, хориоретинит, поражение кроветворных органов с развитием тромбоцитопении, анемии и др.), так и генерализованное поражение. При антенатальном инфицировании плода беременность, как правило, заканчивается преждевременными родами, а клинические симптомы инфекционного заболевания проявляются уже при рождении. В то же время при интранатальном заражении плода сроки реализации инфекционно-воспалительного процесса часто сдвинуты от момента родов, в результате чего манифестация внутриутробной инфекции может произойти не только в первые недели жизни, но даже и в постнеонатальный период. Тем не менее, в подавляющем большинстве случаев внутриутробной инфекции клинические проявления заболевания дебютируют в неонатальный период.
Учитывая тот факт, что эффективное лечение инфекций, в том числе и внутриутробных, возможно только при адекватной этиотропной терапии, в практической неонатологии наиболее приемлемой следует считать классификацию, построенную по этиологическому принципу. В соответствии с МКБ-10, врождённые инфекции представлены в классе XVI «Отдельные состояния, возникающие в перинатальном периоде» в блоках Р35–Р39 «Инфекционные болезни, специфичные для перинатального периода».
Инфекционные болезни, специфичные для перинатального периода (Р35–Р39):
— P35 Врождённые вирусные болезни.
— P35.0 Синдром врождённой краснухи.
— P35.1 Врождённая цитомегаловирусная инфекция.
— P35.2 Врождённая инфекция, вызванная вирусом простого герпеса (Herpes simplex).
— P35.8 Другие врождённые вирусные инфекции.
— P35.9 Врождённая вирусная болезнь неуточнённая.
— P37 Другие врождённые инфекционные и паразитарные болезни.
— P37.0 Врождённый туберкулёз.
— P37.1 Врождённый токсоплазмоз.
— P37.2 Неонатальный (диссеминированный) листериоз.
— P37.3 Врождённая малярия, вызванная Plasmodium falciparum.
— P37.4 Другая врождённая малярия.
— P37.8 Другие уточнённые врождённые инфекционные и паразитарные болезни.
— P37.9 Врождённая инфекционная или паразитарная болезнь неуточнённая.
— P39 Другие инфекционные болезни, специфичные для перинатального периода.
— P39.2 Внутриамниотическая инфекция плода, не классифицированная в других рубриках.
— P39.8 Другая уточнённая инфекция, специфичная для перинатального периода.
— P39.9 Инфекция, специфичная для перинатального периода, неуточнённая.
С практической точки зрения целесообразно выделять инфекции, клинические проявления которых возникли до рождения ребёнка (истинно врождённые инфекции), и перинатальные инфекции, клинические проявления которых манифестируют в течение раннего неонатального периода. При этом крайне важно проводить дифференциальную диагностику между внутриутробной инфекцией, которая развилась в результате интранатального инфицирования, и нозокомиальной инфекцией.
Следует отметить, что врождённую ВИЧ-инфекцию характеризует многолетнее латентное течение, а появление клинических симптомов обусловлено прогрессирующим снижением иммунитета, которое приводит к развитию тяжёлых форм оппортунистических заболеваний.
Установлено, что в подавляющем большинстве случаев врождённые инфекции различной этиологии у новорождённых имеют сходные клинические проявления. Наиболее типичные симптомы таких инфекций: ЗВУР; гепатоспленомегалия; желтуха; экзантемы; дыхательные расстройства; сердечно-сосудистая недостаточность; тяжёлые неврологические нарушения; тромбоцитопения, анемия и гипербилирубинемия с первых дней жизни.
Попытки установить этиологию врождённой инфекции только на основании клинических симптомов редко бывают удачными. Сопоставление клинических признаков врождённого сифилиса, токсоплазмоза, цитомегалии и краснухи приведено в табл. 6.
Клинические признаки TORCH-инфекции плода и новорождённого
Кожно-слизистые поражения, периостит, сопение, положительные серологические реакции
Судороги, микроцефалия, гидроцефалия, лимфаденопатия
Пневмония; клетки с цитомегаловирусными включениями в моче
Катаракта, глаукома, поражения сердца, глухота, микроцефалия, гидроцефалия, поражения костей
0 — признак не упоминается; + — признак присутствует в 1–25% случаев; ++ — признак присутствует в 26–50% случаев; +++ — признак присутствует в 51–75% случаев.
Однотипность клинических проявлений врождённых инфекций обосновывает необходимость своевременного использования лабораторных методов установления этиологии ВУИ . При этом обследование новорождённых и детей первых месяцев жизни должно включать методы, направленные как на выявление возбудителя заболевания, его генома или Аг («прямые» методы диагностики), так и на обнаружение маркёров специфического иммунного ответа («непрямые» методы диагностики,). К «прямым» методам диагностики относят вирусологический, бактериологический и молекулярно-биологический методы (ПЦР, ДНК-гибридизация) и иммунофлюоресценцию. Из «непрямых» методов диагностики (на практике их, как правило, называют серологическими) наиболее широко используют ИФА, при помощи которого в сыворотке крови ребёнка определяют специфические АТ к Аг возбудителя. Для того чтобы получить достоверные результаты серологического обследования и адекватно трактовать эти данные, необходимо соблюдать определённые правила:
— серологическое обследование следует проводить до введения препаратов крови (плазмы, иммуноглобулинов и др.);
— серологическое обследование новорождённых и детей первых месяцев жизни следует проводить с одновременным серологическим обследованием матерей (для уточнения происхождения АТ: «материнские» или «собственные»);
— серологическое обследование следует проводить методом «парных сывороток» с интервалом в 2–3 нед. При этом исследование необходимо выполнять с использованием одной и той же методики в одной и той же лаборатории. Следует особо отметить, что в тех случаях, когда после первоначального серологического обследования ребёнку вводили препараты крови (иммуноглобулин, плазма и др.), исследование «парных сывороток» не проводят;
— оценку результатов серологических исследований проводят с учётом возможных особенностей характера и фазы иммунного ответа.
Особо следует подчеркнуть, что сероконверсия (появление специфических АТ у ранее серонегативного пациента или нарастание титров АТ в динамике), как правило, возникает позже дебюта клинических проявлений инфекции.
Таким образом, при наличии клинико-анамнестических данных, указывающих на вероятность ВУИ у новорождённого, верификацию заболевания необходимо проводить с использованием комплекса прямых и непрямых методов исследования. В практической неонатологии идентификация возбудителя может быть проведена любым из доступных методов. Однако следует помнить, что ни один лабораторный метод установления этиологии ВУИ не имеет абсолютной чувствительности и специфичности. Кроме того, на клиническую информативность лабораторных исследований существенно влияют условия забора, хранения и транспортировки биологического материала, что может быть причиной как ложноположительных, так и ложноотрицательных результатов, поэтому следует строго соблюдать все регламентирующие положения по проведению диагностических исследований. В целом «золотым стандартом» лабораторной верификации ВУИ следует считать комплекс, включающий обязательное использование «прямых» и «непрямых» методов диагностики.
В последнее время для выявления возбудителя в биологическом материале всё чаще используют ПЦР. Материалом может служить любая биологическая среда организма (пуповинная кровь, слюна, моча, смывы трахеи, ротоглотки, мазки с конъюнктивы, из уретры и т.д.). Если этиология заболевания связана с вирусными агентами, критерием активного периода ВУИ считают обнаружение возбудителя в крови или СМЖ (при поражении ЦНС). Если геном вируса обнаруживают в клетках других биологических сред, однозначно определить период заболевания очень трудно. В связи с высокой чувствительностью ПЦР к присутствию генома микроорганизмов, при нарушении правил забора биологического материала высока вероятность ложноположительного результата вследствие контаминации пробы микроорганизмами окружающей среды. Для исключения неправильной клинической интерпретации лабораторных данных, полученных методом ПЦР, в последние годы для целей клинической диагностики рекомендовано использование полуколичественных и количественных вариантов этого метода.
Выявление специфических IgM в пуповинной крови и в крови ребёнка первых недель жизни — один из важных критериев ВУИ . Подтверждением активного периода врождённой инфекции служит также выявление низкоавидных специфических АТ IgG с нарастанием их титров в динамике. При этом обязательно сопоставление полученных данных с результатами параллельного серологического обследования матери. Следует помнить, что выявление специфических IgM или повышение титра низкоавидных АТ в пуповинной крови свидетельствует о внутриутробном контакте плода с соответствующим микроорганизмом, но не доказывает того, что данный микроорганизм — причина инфекционного заболевания. Иными словами, на основании результата исследования можно утверждать лишь о внутриутробном инфицировании плода, но не обязательно о внутриутробной инфекционной болезни.
Для уточнения фазы и остроты инфекционного процесса показано проведение серологического исследования методом ИФА с количественным определением специфических АТ классов IgМ, IgG и оценкой уровня их авидности. Авидность — понятие, характеризующее скорость и прочность связывания Аг с АТ, косвенный признак функциональной активности АТ. В острый период развития инфекции сначала происходит образование специфических Ат к IgМ, затем — специфических низкоавидных АТ к IgG. Таким образом, их можно считать маркёром активного периода заболевания. По мере стихания остроты процесса авидность АТ к IgG нарастает, возникают высокоавидные иммуноглобулины, которые практически полностью заменяют синтез IgM. Таким образом, роль серологических маркёров острой фазы инфекционного процесса играют IgM и низкоавидные IgG. Некоторые авторы указывают также на способность возбудителей TORCH-группы подавлять иммунный ответ плода и новорождённого, что уменьшает диагностическую ценность серологических методов исследования. Изолированное выявление АТ класса IgG в сыворотке крови новорождённого без уточнения индекса авидности и без сопоставления с материнскими титрами не позволяет однозначно трактовать полученные данные, так как АТ могут иметь материнское происхождение (поступление в организм плода за счёт трансплацентарного их переноса). Только при динамическом (с интервалом в 14–21 день) сравнении уровней специфических АТ к IgG новорождённого и матери можно судить об их природе. Если титры специфических АТ к IgG у ребёнка при рождении равны материнским, а при повторном обследовании отмечают их снижение, то высока вероятность, что они имеют материнское происхождение.
Примерно в 50% случаев инфицирование плода происходит от матери с первичной ЦМВИ, причём в 10% случаев речь идёт о рецидиве или обострении инфекции у матери во время беременности. Тяжёлые неврологические осложнения у детей возможны только при первичной ЦМВИ у матери. ЦМВИ, приобретённая во время родов, грудного вскармливания, после переливания препаратов крови и её компонентов, не приводит к тяжёлым неврологическим нарушениям у ребёнка. Вероятность того, что первичное инфицирование женщины, предрасположенной к ЦМВИ, произойдёт в течение данной беременности, составляет менее 1:100. Если беременная женщина всё же заболевает первичной ЦМВИ, то в каждом втором случае происходит инфицирование плода. Если у новорождённого выявлена врождённая ЦМВИ, вероятность неврологических осложнений составляет 1:14. Риск сероконверсии к ЦМВ во время беременности в среднем составляет 2–2,5%. Первичное инфицирование беременной приводит к трансмиссии (передаче) вируса плоду приблизительно в 40–50% случаев. Вероятность врождённой инфекции у детей от серопозитивных матерей составляет не более 0,2–1,5%. Предполагаемая частота клинически выраженной врождённой ЦМВИ в раннем неонатальном периоде составляет 2:1000.
В большинстве случаев инфекция протекает бессимптомно. Поздние проявления ЦМВИ (сенсорная глухота, трудности в обучении, минимальные мозговые дисфункции) развиваются в 10–15% случаев клинически невыраженной инфекции.
Синдром врождённой ЦМВИ (цитомегалия, инклюзионная болезнь) встречается редко. Для данного синдрома типична низкая масса тела при рождении, геморрагическая сыпь, тромбоцитопения, анемия, желтуха, гепатоспленомегалия, микроцефалия и хориоретинит. Более широко распространённым симптомокомплексом, выявляемым у новорождённых с ЦМВИ, считают сочетание низкой массы тела при рождении с гепатоспленомегалией и персистирующей желтухой.
Интранатальное или постнатальное заражение обычно приводит к латентной инфекции, которая клинически манифестирует на фоне снижения иммунитета. Инкубационный период составляет 3 нед и более. По истечении данного срока у новорождённого возможно возникновение гепатоспленомегалии, лимфаденопатии и пневмонии. При клиническом анализе крови выявляют атипичные лимфоциты. Тяжёлая интерстициальная пневмония или ЦМВИ в результате гемотрансфузии могут привести к летальному исходу у недоношенных новорождённых.
У детей, инфицированных антенатально, происходит выделение ЦМВ в высоких титрах с мочой и слюной, что позволяет легко и быстро обнаружить заболевание с помощью вирусологического исследования. Для выявления вируса необходимо собрать слюну в ёмкость с культуральной средой. Мочу и другие биологические жидкости посылают в лабораторию на льду (при температуре 0–4 °С). Замораживание собранного материала приводит к инактивации вируса. Диагностическое значение имеет также определение специфических IgM к ЦМВ в сыворотке пуповинной и периферической крови новорождённого с помощью ИФА. Частицы вируса могут быть обнаружены при электронной микроскопии слюны, осадка мочи или биоптата печени. При цитологическом исследовании осадка мочи или тканей печени в ряде случаев можно определить типичные гигантские клетки с включениями («совиный глаз»). Для обнаружения ДНК вируса используют ПЦР. Наличие стабильных высоких титров специфических анти-цитомегаловирусных АТ класса IgG в возрасте 6–12 нед ретроспективно подтверждает диагноз врождённой ЦМВИ. Для установления степени тяжести ЦМВИ необходимо провести дополнительные диагностические исследования, включающие НСГ, рентгенографию черепа или КТ (для выявления внутричерепных кальцификатов), рентгенографию трубчатых костей и грудной клетки, биохимическое исследование функций печени.
В последние годы для лечения тяжёлых форм врождённой ЦМВИ в ряде стран с определённым успехом используют ганцикловир. Однако, в связи с отсутствием регистрационного разрешения Фармкомитета РФ на использование этого препарата у детей раннего возраста, специфическую противовирусную химиотерапию врождённой ЦМВИ в нашей стране не применяют. Для уменьшения виремии можно использовать препараты иммуноглобулина для внутривенного введения (специфический антицитомегаловирусный или поливалентные иммуноглобулины). При этом режим дозирования специфического антицитомегаловирусного иммуноглобулина для внутривенного введения (НеоЦитотект) составляет 1 мл/кг (100 МЕ/кг) с интервалом 48 ч. В течение первых 10 мин введения скорость инфузии не должна превышать 0,08 мл/(кгxч). При отсутствии клинических проявлений анафилаксии скорость введения постепенно увеличивают до 0,8 мл/(кгxч). Кратность введения при этом зависит от динамики регресса клинических проявлений инфекции и составляет обычно не менее 3–5 инфузий. В настоящее время проводят исследования по оценке клинической эффективности лечения врождённой ЦМВИ препаратами альфа-интерферонов. В связи отсутствием данных о сравнительных многоцентровых исследованиях, рекомендации по использованию для лечения заболевания отечественного препарата интерферона альфа-2 следует рассматривать как предварительные, а само лечение — как вспомогательное.
Поскольку при врождённой неонатальной ЦМВИ возможно развитие глухоты, показано исследование состояния органа слуха у больных детей методом слуховых вызванных потенциалов. Дети с врождённой ЦМВИ могут являться источником заражения для окружающих. Не рекомендуется допускать к уходу за больными детьми беременных женщин. В настоящее время идёт разработка живой противовирусной вакцины.
В развитии неонатального герпеса играют роль два серотипа вируса простого герпеса. У новорождённых тяжёлое генерализованное заболевание с высоким уровнем летальности чаще вызывает вирус простого герпеса 2-го типа. Вместе с тем, изолированные герпетические энцефалиты чаще обусловлены вирусом простого герпеса 1-го типа. Риск герпетической инфекции у ребёнка при родах через естественные родовые пути матери с первичной генитальной инфекцией составляет 33–50%. Риск для ребёнка, рождённого матерью, выделяющей вирус простого герпеса в результате реактивированной инфекции, значительно ниже — до 5%. Трансплацентарное заражение, приводящее к самопроизвольному прерыванию беременности или врождённым порокам развития, встречается редко. Чаще заражение происходит в процессе родов при контакте с выделениями из половых путей матери. В связи с этим основное значение имеет возникновение или обострение генитального герпеса у матери на последнем месяце беременности. В этом случае возможно инфицирование восходящим путём при преждевременном излитии околоплодных вод. Трансмиссивная передача происходит также при нарушении целостности кожного покрова плода. Операция кесарева сечения, проведённая не позже чем через 4 ч после разрыва околоплодных оболочек, уменьшает риск заболевания новорождённого в 10 раз. Частота возникновения ВУИ , вызванной вирусом простого герпеса 1-го и 2-го типов, неизвестна. Предполагаемая заболеваемость в России — 1 случай на 2000–3000 живорождённых.
Бессимптомное течение инфекции встречается редко. Герпетическое поражение бывает локализованным или генерализованным. Среди локализованных форм выделяют герпетическое поражение кожи или глаз. Генерализованная инфекция манифестирует признаками, характерными для сепсиса. Изолированное поражение ЦНС (герпетический менингоэнцефалит) протекает с лихорадкой, вялостью, плохим аппетитом, гипогликемией, ДВС-синдромом или синдромом повышенной нервно-рефлекторной возбудимости, за которым следуют купируемые с трудом судороги. Важный симптом заболевания — типичные везикулёзные элементы, выявляемые при осмотре кожи и слизистых ротовой полости.
Для выявления герпетической инфекции используют следующие методы:
— соскоб стенки везикул, повреждённых участков кожи и слизистых оболочек исследуют с помощью микроскопии (в мазке по Тцанку выявляются гигантские многоядерные клетки) или прямым иммунофлюоресцентным методом для обнаружения Аг вируса простого герпеса;
— исследование крови, СМЖ, содержимого везикул, а также мазков из зева и глаз;
— обследование матери на наличие вагинальных, цервикальных или других герпетических повреждений (посевы следует проводить даже при отсутствии клинической картины);
— при возникновении у новорождённого генерализованной инфекции неясной этиологии, когда нет эффекта от целенаправленной антибактериальной терапии, необходима дифференциальная диагностика между сепсисом и генерализованной герпетической инфекцией.
Определение содержания противогерпетических АТ у матери не имеет диагностического и прогностического значения при определении риска развития инфекции у новорождённого.
Наиболее эффективным методом профилактики герпетической инфекции у новорождённых, у матерей которых в III триместре беременности выявлен генитальный герпес, считают родоразрешение путём операции кесарева сечения до момента разрыва околоплодных оболочек. В случае преждевременного разрыва околоплодных оболочек данная операция эффективна, если выполнена не позднее чем через 4 ч после излития околоплодных вод. Ребёнка с любой формой герпетической инфекции или с подозрением на герпес необходимо изолировать от других новорождённых.
Учитывая тяжёлые последствия герпетической инфекции, во всех случаях подозрения на неонатальный герпес, а также при высоком риске его развития у новорождённого (рождение через естественные родовые пути женщины с генитальным герпесом, выявленным во время родов или за несколько недель до них) есть основания для начала противовирусной терапии ацикловиром. При всех клинических формах герпетической инфекции у новорождённого, включая изолированные поражения кожи, противовирусная терапия ацикловиром показана в обязательном порядке. Доза препарата и длительность лечения зависит от клинической формы заболевания, а также (в сомнительных случаях) от результатов лабораторного и инструментального обследования ребёнка.
Согласно рекомендациям Российской ассоциации специалистов перинатальной медицины (2002), при изолированном поражении кожи ацикловир применяют в дозе 45 мг/(кгxсут), разделённой на 3 введения (по 15 мг/кг каждые 8 ч) в виде медленной инфузии в течение 10–14 дней. Многоцентровые исследования, проведённые в последние годы, доказывают целесообразность использования при локализованном герпесе такой же дозы, как и при генерализованной форме. При генерализованной форме, герпетическом поражении ЦНС или офтальмогерпесе дозу ацикловира увеличивают до 60 мг/(кгxсут) (по 20 мг/кг каждые 8 ч). Длительность лечения составляет 14–21 день. При офтальмогерпесе одновременно с парентеральным введением целесообразно использовать глазную мазь, содержащую ацикловир.
Toxoplasma gondii — облигатный внутриклеточный паразит, поражающий птиц и млекопитающих. Промежуточный хозяин — представители семейства кошачьих. Только первичная (обычно бессимптомная) инфекция матери приводит к врождённой инфекции. Риск трансплацентарной передачи инфекции возрастает от 15% в I триместре до 65% в конце беременности.
Классическая триада в виде гидроцефалии, хориоретинита и внутричерепных кальцификатов возможна у новорождённых, инфицированных в I триместре беременности. У некоторых новорождённых возникает клиническая картина сепсиса. Новорождённые, инфицированные в конце беременности, при рождении обычно не имеют клинических признаков заболевания.
Для постановки диагноза применяют следующие серологические методы обследования:
— тест с окраской по Сейбину — чувствительный и высокоспецифический, но выполним только с живыми паразитами;
— ИФА — легкодоступный и наиболее часто используемый тест;
Методом ИФА выявляют специфические IgM, ранние АТ в острой фазе инфекции. Методика редко применяется ввиду её технической сложности, кроме того, у некоторых внутриутробно инфицированных новорождённых наблюдают недостаток выработки АТ к IgM.
Наиболее эффективны препараты пириметамина в комбинации с сульфаниламидами, которые блокируют функцию ферментов (редуктазы и синтетазы), участвующих в синтезе фолиевой кислоты паразита. Суточная доза пириметамина составляет 1 мг/кг (в 2 приёма), сульфаниламидов короткого действия — 0,1мг/кг (в 3–4 приёма).
Оправдала себя схема применения препаратов циклами: пириметамин — 5 дней, сульфаниламид — 7 дней. Проводят 3 цикла с интервалами 7–14 дней. Такой курс терапии по показаниям (хроническая форма при иммунодефицитном состоянии, обострение хориоретинита и пр.) повторяют через 1–2 мес, при непереносимости сульфаниламидов возможна терапия пириметамином в комбинации с клиндамицином по 10–40 мг/(кгxсут) в 3 введения.
Противопаразитарный эффект препаратов ко-тримоксазола также обусловлен действием на метаболизм фолиевой кислоты возбудителя. Побочные действия всех антифолатов устраняют назначением производного фолиевой кислоты. Препарат восполняет дефицит фолиевой кислоты больного и способствует восстановлению биосинтеза нуклеиновых кислот. Официнальный препарат кальция фолинат назначают по 1–5 мг 1 раз в 3 дня в течение всего курса терапии. На втором месте по эффективности стоят макролиды, тормозящие синтез белка на рибосомах возбудителя, учитывают также их меньшую токсичность и действие на внутриклеточные формы паразита. Спирамицин назначают по 150 000–300 000 Ед/кг — суточная доза в 2 приёма в течение 10 дней, рокситромицин — по 5–8 мг/кг в сутки, азитромицин — по 5 мг/кг в сутки в течение 7–10 дней.
Хламидии представляют большую группу облигатных внутриклеточных паразитов, близких к грамотрицательным бактериям. Хламидии лишены собственной дыхательной системы, используют дыхательную систему клеток хозяина и целиком зависят от него. Существуют несколько видов хламидий. Chlamydia trachomatis играет существенную роль в патологии неонатального периода. Chlamydia psittaci (по современной номенклатуре СМа-mydophila psittaci) является возбудителем орнитоза. Chlamydia pneumoniae (или TWAR-штамм) (по современной номенклатуре Chlamydophila pneumoniae) вызывает некоторые виды воспаления легких, бронхиты и синуситы у человека и животных. К другим видам относятся Chlamydia muridarum, abortus, caviae, felis, pecorum (по современной номенклатуре Chlamydophila).
При остром течении внутриутробного хламидиоза возможно развитие конъюнктивита, пневмонии, бронхита, назофарингита, отита, сепсиса, менингоэнцефалита, уретрита, цервицита, вульвовагинита, энтероколита, реактивного артрита, кардита. Наибольшее значение в патологии новорожденных, инфицированных хламидиями, имеют офтальмохламидиоз и хламидийная пневмония.
При латентной дремлющей инфекции нет постоянного размножения возбудителя, но оно начинается в условиях сниженной иммунной защиты, что может вести к проявлению симптомов заболевания через несколько дней и недель жизни. Латентное течение хламидийной инфекции у ребенка не исключает возможность репродукции хламидий в клетках и тканях центральной нервной системы и экстраневрально, следствием чего может явиться развитие астеновегетативного синдрома, судорожных и ликвородинамических нарушений. Поздняя диагностика и отсутствие ранней специфической терапии ведет к развитию хронических форм заболевания. Формирование латентной или персистирующей инфекции способствует развитию вторичного иммунодефицита и аутоиммунных заболеваний. Особенностью хламидиоза является отсутствие патогномоничных признаков и неспецифичность клинической симптоматики в периоде новорожденности. Хламидийная инфекция осложняет адаптацию новорожденных и проявляется неврологическими нарушениями, дыхательными расстройствами, отёчным и геморрагическим синдромами, офтальмопатией, длительной и выраженной желтухой, замедленной потерей и восстановлением массы тела после рождения. Иногда хламидиоз проходит под диагнозами «внутриутробная гипоксия» и родовая травма. Наиболее характерными являются церебральные расстройства. Уже в первые часы жизни появляются неврологические нарушения в виде синдромов нервно-рефлекторной возбудимости или угнетения функции ЦНС. Нарушения неврологического статуса в большинстве случаев имеют стойкий характер. Отмечены повышенное беспокойство, расстройство сна, повышенная реактивность, изменение мышечного тонуса, угнетение физиологических рефлексов, тремор конечностей. Дети склонны к быстрому охлаждению или перегреванию, у них длительно сохраняются локальный цианоз, мраморность кожи.
Изучение микробиологических особенностей хламидий (с внутриклеточным циклом развития) объясняют неэффективность бета-лактамных антибиотиков и обусловливают применение антибактериальных препаратов, способных проникнуть и накапливаться в пораженных клетках и межклеточных пространствах. Данными свойствами обладают макролиды, тетрациклины фторхинолоны, которые и являются средствами эрадикационной терапии при хламидийной инфекции.
Макролиды имеют основное клиническое значение в отношении грамположительных кокков и внутриклеточных возбудителей, оказывая бактериостатическое действие. Они являются на сегодняшний день единственной группой антибиотиков, истинная резистентность к которой у патогенных для человека хламидий практически не встречается. Наиболее широко используют три группы макролидов:
I группа – 14 –членные (эритромицин, кларитромицин, рокситромицин);
II группа – 15 –членные (азитромицин);
III группа – 16 –членные (джозамицин, спирамицин, мидекамицин).
Одним из иммуномодулирующих препаратов является Генферон- Лайт -комбинированный препарат, действие которого обусловлено компонентами, входящими в его состав. Оказывает местное и системное действие.
В состав препарата Генферон- Лайт входит рекомбинантный человеческий интерферон альфа-2b, вырабатываемый штаммом бактерии Escherichia coli, в которую методами генной инженерии введён ген интерферона альфа-2b человека.
Интерферон альфа-2b оказывает противовирусное, иммуномодулирующее, антипролиферативное и антибактериальное действие. Противовирусный эффект опосредован активацией ряда внутриклеточных ферментов, ингибирующих репликацию вирусов. Иммуномодулирующее действие проявляется, в первую очередь, усилением клеточно-опосредованных реакций иммунной системы, что повышает эффективность иммунного ответа в отношении вирусов, внутриклеточных паразитов и клеток, претерпевших опухолевую трансформацию. Это достигается за счёт активации CD8+ T- киллеров, NK – клеток (естественных киллеров), усилении дифференцировки B – лимфацитов и продукции ими антител, активации моноцитарно-макрофагальной системы и фагоцитоза, а также повышении экспрессии молекул главного комплекса гистосовместимости I типа, что повышает вероятность распознавания инфицированных клеток клетками иммунной системы. Активизация под воздействием интерферона лейкоцитов, содержащихся во всех слоях слизистой оболочки, обеспечивает их активное участие в ликвидации патологических очагов; кроме того, за счёт влияния интерферона достигается восстановление продукции секреторного иммуноглобулина А. Антибактериальный эффект опосредован реакциями иммунной системы, усиливаемыми под влиянием интерферона.
Таурин способствует нормализации метаболических процессов и регенерации тканей, обладает мемраностабилизирующим и иммуномодулирующим действием. Являясь сильным антиоксидантом, таурин непосредственно взаимодействует с активными формами кислорода, избыточное накопление которых способствует развитию патологических процессов. Таурин способствует сохранению биологической активности интерферона, усиливая терапевтический эффект применения препарата.
При ректальном введении препарата отмечается высокая биодоступность (более 80%) интерферона, в связи с чем достигается как местное, так и выраженное системное иммуномодулирующее действие; при интравагинальном применении за счёт высокой концентрации в очаге инфекции и фиксации на клетках слизистой оболочки достигается выраженный местный противовирусный, антипролиферативный и антибактериальный эффект, при этом системное действие за счёт низкой всасывающей способности часов после введения препарата. Основным путём введения ά- интерферона является почечный катаболизм. Период полувыведения составляет 12 часов, что обусловливает необходимость применения препарата 2 раза в сутки.
Назначается Генферон- Лайт по 1 суппозиторию 2 раза в сутки через 12 часов. Курс лечения составляет 5 дней, при необходимости добавляется этиотропная терапия (антибиотик и/или симптоматические средства).
5. НЕДОНОШЕННЫЕ НОВОРОЖДЕННЫЕ ДЕТИ: АНАТОМО-ФИЗИОЛОГИЧЕСКИЕ ОСОБЕННОСТИ, ВЫХАЖИВАНИЕ, ВСКАРМЛИВАНИЕ
Преждевременные роды (рождение недоношенного ребенка) — это роды, происшедшие до окончания полных 37 недель беременности. Срок беременности (срок гестации) условно отсчитывают с первого дня последнего менструального цикла. Может использоваться термин «постконцептуальный возраст» — предполагаемый общий (т.е. гестационный плюс постнатальный) возраст недоношенного ребенка в неделях с начала последнего менструального цикла матери. Учреждения здравоохранения должны осуществлять регистрацию всех детей, родившихся живыми и мертвыми, которые имеют массу тела при рождении 500 г и более, длину — 25 см и более, при сроке беременности 22 нед. и более. Однако по-прежнему государственная статистика из рожденных живыми учитывает только детей с 28 нед. гестации и более (масса тела 1000 г и более, длина 35 см и более). Из родившихся живыми с массой тела 500—999 г подлежат регистрации в органах ЗАГСа только те новорожденные, которые прожили 168 часов (7 суток).
Согласно приказу Минздрава России №318 от 04.12.92 рекомендована следующая терминология: все дети с массой тела
источник


