Автоматические методы анализа клеток крови. Основные источники ошибок при подсчете эритроцитов и лейкоцитов в камере. Особенности влияния различных факторов на результаты исследования крови. Информативность и достоверность гематологических тестов.
Постоянно циркулируя в замкнутой системе кровообращения, кровь объединяет работу всех систем организма и поддерживает многие физиологические показатели внутренней среды организма на определенном, оптимальном для осуществления обменных процессов уровне. На основе циркуляции форменных элементов и составных веществ плазмы кровь выполняет в организме разносторонние жизненно важные функции: дыхательную, трофическую, защитную, регуляторную, выделительную и другие. Конкретное понимание многочисленных функций крови возможно лишь на основе изучения строения и свойств ее основных компонентов форменных элементов и плазмы.
Соблюдение всех методик и руководств по забору венозной и капиллярной крови влияет на точность выдаваемого результата. Снижение до минимума возможных ошибок и обеспечение высокого качества гематологических исследований возможно при стандартизации преаналитического и аналитического этапов работы.
1. Этапы лабораторного анализа
Продукция медицинской лаборатории — авторизованный отчёт, содержащий результаты лабораторного исследования, а также данные о пациенте (имя, возраст, пол, диагноз), вид биологической пробы, время её взятия и доставки в лабораторию, актуальные референсные интервалы для каждого аналита и другую информацию. Иными словами, лаборатория производит и поставляет клиницисту в той или иной степени достоверную, чаще объективную диагностическую информацию.
Цикл производства этого продукта принято разделять на три основных этапа:
Взятие биологического материала с использованием антикоагулянтов.
Аналитическое исследование на гематологическом анализаторе.
Оформление бланка с результатами теста (может выполняться на самом анализаторе).
Оценка результата по интервалам норм.
Использование результатов в диагностическом процессе.
Качество результатов исследования крови на гематологических анализаторах определяется следующими факторами:
— качеством используемых реагентов.
— точностью дозирования цельной или разведённой крови;
— точностью дозирования изотонического раствора при разведении крови;
— точностью определения объёма суспензии клеток, пропущенной через апертуру;
— точностью самого подсчёта клеток;
— точностью определения размеров клеток;
— корректностью математических методов обработки первичных результатов измерения.
· постаналитический — интерпретация результатов, диагноз и лечение пациента.
Если аналитический этап полностью проходит в лаборатории, то два других этапа имеют довольно основательную внелабораторную составляющую. И эта их особенность значительно затрудняет проведение согласованных, последовательных мероприятий по обеспечению качества.
1.1 Организация и обеспечение качества на преаналитическом этапе
Основа обеспечения качества на преаналитическом этапе — разработка и чёткое соблюдение инструкции по качеству проведения этой стадии лабораторного исследования, а также максимальная стандартизация всех основных моментов.
Подготовка пациента к исследованиям — одна из важных составляющих внелабораторной части этапа. Врач должен обязательно объяснить пациенту необходимость лабораторных исследований и информировать пациента о том, как ему нужно подготовиться к исследованиям.
При обращении в лабораторию пациентам сообщаются условия правильной подготовки к сдаче анализа. В доступных местах вывешены графики проведения анализов, а также буклеты с информацией о проводимых исследованиях. Качественное взятие материала является одним из стандартизирующих и предопределяющих моментов всего лабораторного исследования.
При регистрации данных пациента в лаборатории используют современную лабораторную информационную систему (LIS). LIS обеспечивает надёжную регистрацию, хранение и быстрый поиск результатов исследований. При регистрации данных в лаборатории используют штрих-кодирование. Штрих-код считывается специальным сканером, и заявленные аналиты автоматически переносятся в лабораторную информационную систему.
Транспортировка. Особое значение имеет стандартизация процесса транспортировки проб в лабораторию. При выполнении гематологических исследований на значительном удалении от места взятия крови неизбежно возникают проблемы, связанные с неблагоприятными условиями транспортировки. Воздействие механических факторов (тряска, вибрация, перемешивание и т.д.), нарушения температурного режима, вероятность пролива и загрязнения проб могут оказывать влияние на качество анализов. Для устранения этих причин при перевозках пробирок с кровью рекомендуется использовать герметично закрытые пластиковые пробирки и специальные транспортные изотермические контейнеры.
Основная форма контроля преаналитического этапа — периодические внешние и внутренние инспекционные проверки (аудит).
1.2 Организация и обеспечение качества на аналитическом этапе
В отличие от пре- и постаналитического этапов, где основными формами контроля служат периодические инспекционные проверки (внешние и внутренние), контроль качества аналитического этапа — это, прежде всего, оценка результатов измерений контрольных образцов.
Выделяют внутрилабораторный контроль качества и внешнюю оценку качества исследований. Под внутрилабораторным контролем качества понимают проверку результатов измерений каждого аналита в каждой аналитической серии, осуществляемую ежедневно непосредственно в лаборатории путём использования принятых алгоритмов оценки измерений контрольных материалов, преимущественно с целью оценить их воспроизводимость (близость результатов измерений одной и той же величины, полученных в разное время).
Цель внутрилабораторного контроля — выявление и устранение недопустимых отклонений от стабильного выполнения теста в лаборатории, т. е. выявление и устранение недопустимых аналитических ошибок.
Контрольный материал — однородный стабильный материал, результаты исследования которого используют для оценки погрешности выполняемых аналитических измерений. Один из основных принципов выбора контрольного материала — при использовании реактивов и калибраторов одного производителя рекомендуется применять аттестованные контрольные материалы другого производителя. Для систематического оперативного слежения за стабильностью аналитической системы по результатам исследования контрольных проб используются контрольные карты (карты Levey-Jennings). Контрольная карта графическое изображение полученных в установочной серии статистических характеристик вариаций аналитической системы, соответствующих требованиям к её точности. Оперативный контроль качества результатов измерения аналита в пробах пациентов осуществляют путём измерения этого аналита в контрольных материалах в каждой аналитической серии и нанесении полученных результатов на контрольные карты. Выявление и устранение отклонений от стабильного выполнения теста в лаборатории является целью внутрилабораторного контроля качества. Контрольные карты строятся для каждого аналита и для каждого уровня контрольного материала, предназначенного для оперативного контроля качества. Целью внешней оценки качества исследований является оценка соответствия результатов исследований установленным нормам аналитической точности. Внешняя оценка качества — объективная проверка результатов лаборатории, осуществляемая периодически внешней организацией. Любая хорошо организованная система внешней оценки качества предназначена для сопоставления результатов анализов между лабораториями с целью гармонизации результатов лабораторных исследований.
1.2.1 Возможные ошибки лабораторных исследований крови
Лабораторный этап обработки проб крови вносит свой вклад в погрешность результатов, которые можно разделить на три вида: случайные, систематические и грубые.
Случайными называются неопределенные по величине и знаку ошибки, в появлении которых не наблюдается закономерности. Случайные ошибки сопутствуют любому измерению, как бы тщательно оно не проводилось, и проявляются в некотором различии результатов измерения одного и того же элемента, выполненного данным методом. Эти развития обусловлены колебаниями:
1) свойств пробы — негомогенность, неравномерность перемешивания;
2) точности измерительного инструмента — пипеток, мерной посуды, термо- и фотометрических приборов, счетных камер;
3) точности работы персонала лаборатории — неточное пипетирование или считывание результатов, ошибка утомления, неверный подбор класса точности инструментов, психологическая ошибка, например, оказание предпочтения каким-либо цифрам и т.д.
Величина случайной ошибки характеризует воспроизводимость результатов исследований.
К систематическим ошибкам относятся погрешности, происходящие от определенных причин. Одинаковые по знаку, они либо увеличивают, либо уменьшают истинные результаты. После выяснения причины, вызывающей систематическую ошибку, ее можно устранить или ввести поправочный коэффициент.
Причиной систематических ошибок являются:
— методические ошибки, обусловленные возможностью метода анализа; наиболее серьезная, и трудно устранимая причина искажений результатов;
— ошибки, зависящие от применяемых приборов и реактивов, определяются точностью приборов, загрязнением реактивов продуктами разрушения тары, взаимодействием с воздушной средой и испарениями других реактивов и др.;
— ошибки оперативные, происходящие от неправильного или неточного выполнения операции, например, изменение времени окрашивания, неправильное выливание растворов из пипеток;
— ошибки индивидуальные, зависящие от личных способностей оператора, его органов чувств, привычек.
Величина систематической ошибки влияет на всю серию определений и характеризует правильность результатов анализа.
Грубыми ошибками называют полученные одиночные значения анализируемого параметра, выходящие за пределы допустимой величины погрешностей. Причиной грубых ошибок может стать неправильная доза препарата, ошибки в расчетах, небрежность или недостаточная тщательность в работе. Необходимо отличать грубые ошибки от показателей, характеризующих резкие изменения исследуемых параметров; последние проверяются повторными или параллельными анализами.
Среди способов выявления случайных ошибок в лабораторной практике применяют анализ двух (или нескольких) параллельных проб а также последовательное проведение анализов повторно у одного и того же животного. Расхождение результатов свидетельствует об ошибке.
Если все или большинство результатов, полученных в течение дня, отличается от обычных значений возможно присутствие систематической ошибки. В поисках ее причин полезным подспорьем являются записи в лабораторном журнале, анализ которых позволяет выявить значение новой партии реактива, составление нового калибровочного графика или реактива, отключение для профилактики холодильника или термостата, замена ламп в фотометре и т.д. Использование автоматических устройств для анализа ведет к сокращению числа случайных ошибок, но увеличивает необходимость контроля за систематическими погрешностями.
Таким образом, высокая точность измерений, отражающая близость их результатов к истинному значению измеряемой величины, соответствует малым значениям ошибок всех видов и обеспечивается наряду с контролем всех элементов клинико-диагностических исследований унификацией и стандартизацией методов анализа
Основными источниками ошибок при подсчете эритроцитов являются:
*Неточное взятие крови в пипетку.
*Образование сгустка, поглощающего часть клеток и занижающего результат
*Недостаточное перемешивание содержимого пробирки перед заполнением камеры.
*Неправильная подготовка камеры: недостаточное притирание покровных стекол;
неравномерное заполнение камеры, образование пузырьков воздуха.
*Подсчет эритроцитов сразу после заполнения камеры, не выжидая 1 минуту.
*Подсчет меньшего, чем требуется по методике, количества квадратов.
*Плохо вымытые камера, пробирки, пипетка, капилляр для взятия крови;
недостаточно просушенные пробирки и пипетки.
* Использование недоброкачественного разводящего раствора.
Основные источники ошибок при подсчете лейкоцитов в камере:
* Неправильное соотношение объемов крови и уксусной кислоты, взятые в пробирку.
* Неправильно подготовленный раствор уксусной кислоты (при концентрации большей, чем 5%, часть лейкоцитов может лизироваться, что приведет к занижению результата).
*Длительное нахождение пробы при температуре выше 28°С, что может ускорить лизис лейкоцитов в образце и привести к занижению результата.
*Неправильное заполнение камеры Горяева. Как и при подсчете эритроцитов, камеру необходимо оставлять на 1 минуту для оседания клеток.
*Недостаточно хорошо отмытая после предыдущего определения камера Горяева.
Оставшиеся в камере лейкоциты могут завышать результаты анализа.
1.3 Организация и обеспечение качества на постаналитическом этапе
Как и преаналитический этап, этот этап можно разделить на внутрилабораторную и внелабораторную части. Основной элемент внутрилабораторной части постаналитического этапа проверка квалифицированным лабораторным специалистом результата анализа на предмет его аналитической достоверности, биологической вероятности или правдоподобия, а также сопоставления каждого результата с референсными интервалами. На этапе проверки результатов исследований важно учитывать факторы, препятствующие определению аналита (такие как гемолиз, липемия, избыточная желтушность, парапротеинемия и др) и являющиеся критериями отказа. Степень влияния этих факторов часто зависит от метода измерения аналита, поэтому на преаналитической стадии сомнительная проба может быть принята на исследование. Форматированию бланков отчёта уделяют особое внимание: используется группировка результатов по патофизиологическому принципу с указанием референсных значений, что значительно упрощает трактовку результатов. Эта часть этапа заканчивается подписью (авторизацией) бланка отчёта, т. е. формированием конечного продукта лабораторного процесса и передачей его клиницисту.
Внелабораторная часть — это, прежде всего, оценка лечащим врачом клинической значимости информации о состоянии пациента, полученной в результате лабораторного исследования. Авторизованный отчёт с результатами лабораторных исследований поступает клиницисту, который интерпретирует полученную лабораторную информацию, сопоставляет её с данными собственного наблюдения за пациентом и результатами других видов исследований и использует её для оказания пациенту медицинской помощи.
Как и для преаналитического этапа, основная форма контроля качества проведения постаналитического этапа — это периодические внешние и внутренние проверки (аудит).
2. Автоматические методы анализа клеток крови
Гемограммой называют профиль исследований, состоящий из определения количества лейкоцитов, эритроцитов, гематокритной величины и концентрации гемоглобина. Автоматизация в гематологии предлагает новый подход к дифференцированию лейкоцитов. В большинстве случаев отклонения лейкоцитарной формулы от нормального распределения требуют дополнительного исследования мазка крови под микроскопом. На основе анализа тысяч клеток гематологические анализаторы способны представлять данные в виде гистограмм — распределений клеток по размерам. Большинство анализаторов представляет в виде гистограмм распределение по размерам тромбоцитов, лейкоцитов и эритроцитов.
Все многообразие гематологических приборов можно разделить на 3 класса с учетом их технической характеристики.
1 класс — полуавтоматические счетчики клеток крови определяющие обычно от 4 до 10 параметров (лейкоциты, эритроциты, гемоглобин, гематокрит, средний объем эритроцита, среднее содержание гемоглобина в эритроците, средняя концентрация гемоглобина в эритроцитарной массе, тромбоциты, средний объем тромбоцита). Данные приборы в большинстве своем используют в работе предварительно разведенную кровь, поэтому комплектуются дилютерами. В основе подсчета и анализа клеток в счетчиках лежит кондуктометрический метод.
2 класс — автоматические анализаторы, проводящие анализ цельной крови и определяющие до 20 параметров, включая расчетные показатели красной крови и тромбоцитов по объему, а так же проводящие частичную дифференцировку лейкоцитов по 3 параметрам (гранулоциты, лимфоциты и «средние клетки», состоящие преимущественно из эозинофилов и базофилов). В основе подсчета и дифференцировки клеток в анализаторах данного класса лежит кондуктометрический метод, который дополняется системами внутреннего контроля качества, волюметрического контроля и т.д.
3 класс — высокотехнологические гематологические анализаторы, позволяющие проводить развернутый анализ крови, включая полную дифференцировку лейкоцитов по 5 параметрам (нейтрофилы, эозинофилы, базофилы, моноциты и лимфоциты), гистограммы распределения лейкоцитов, эритроцитов и тромбоцитов по объему, скетограммы. В основе работы приборов этого класса лежит комбинация кондуктометрического метода с другими методами (рассеяние лазерного луча, радиочастотный, цитохимический, использование различный дифференцирующих лизатов и т.д.).
Работа с гематологическими анализаторами требует предельной аккуратности и точности, строгого соблюдения требований соответствующих инструкций к прибору. Большинство ошибок и неточностей при работе с гематологическим анализаторами связано с техническими погрешностями: низкое качество разводящих жидкостей, погрешности при заборе крови, грязная посуда, удлинение интервала времени между забором крови или приготовлением разведений и подсчетом клеток и т.п. Однако существует категория ошибок, связанных с особенностью патологических образцов крови.
Концентрация гемоглобина (HGB).
В большинстве гематологических анализаторов для определения концентрации гемоглобина используется цианметгемоглобиновый колориметрический или спектрофотометрический метод.
Причины возможных ошибок при определении концентрации гемоглобина:
O Технические ошибки: нарушение правил забора крови, нарушение инструкции к анализатору, попадание в пробу моющих средств, остатков спирта с пальца пациента, низкое качество реактивов и т.д.
O Связанные с особенностями исследуемой крови при патологи (завышение результатов анализа): высокий лейкоцитоз (>30·109/л), парапротеинемия (преципитация патологических иммуноглобулинов), агглютинация эритроцитов при парапротеинемиях, аутоиммцнных процессах, уремия (при гиперосмолярности плазмы нарушается лизис эритроцитов), гиперлипопроитеинемия, гипербилирубинемия, внутрисосудистый гемолиз.
Количество эритроцитов в единице объема крови (RBC).
Количество гематологическими анализаторами определяется кондуктометрическим методом.
Причины ошибок при подсчете эритроцитов следующие:
O Связанные с особенностями исследуемой крови (внутрисосудистый гемолиз эритроцитов, агглютинация эритроцитов, наличие большого числа микро- и шизоцитов (эти элементы паодсчитываются ангализатором как тромбоциты)
O Высокий лимфоцитоз (>50·109/л) с преобладанием малых лимфоцитов.
Количество лейкоцитов (WBC).
Увеличение или снижение количества лейкоцитов интерпретируется соответственно клиническому случаю (лейкоцитозы, лейкопении, лейкемоидные реакции и др.) параллельно с анализом изменений в лейкоцитарной формуле.
Причины ошибок при подсчете лейкоцитов:
O Связанные с особенностями исследуемой крови
O Наличие аутоантител к лейкоцитам, формирование агглютинатов лейкоцитов, которые прибор считает как одну клетку
O Наличия хрупких, легко разрушающихся клеток при лейкозах, тяжелых интоксикациях
В большинстве гематологических анализаторов используется кондуктометрический метод, позволяющий дифференцировать лейкоциты в зависимости от их объема. Результаты исследования отражены в лейкоцитарных гистограммах и цифровом выражении относительного и абсолютного количества различных форм лейкоцитов. В зависимости от категории прибора подсчитывается количество одного, двух, трех и более видов лейкоцитов.
Точная дифференцировка лейкоцитов на отдельные популяции, выявление тонких морфологических изменений в клетках возможны только с помощью микроскопического исследования окрашенного мазка крови. Дифференцированный подсчет лейкоцитов гематологическим анализатором — это скрининг, при котором все патологические результаты подлежат последующему микроскопическому исследованию.
Количество тромбоцитов (PLT).
Число тромбоцитов в автоматических счетчиках определяется прямым кондуктометрическим методом. Подсчитываются частицы объемом 2-30 фл.
Ошибки при определении количества тромбоцитов:
O Технические: неправильное взятие крови (трудности в нахождении вены, венозный застой, повреждение эндотелия и др.) способствуют агрегации тромбоцитов, образованию микросгустков.
O Ошибки, связанные с особенностями исследуемой крови (наличие антител к тромбоцитам, в результате чего наступает агрегация тромбоцитов, прилипание тромбоцитов к лейкоцитам (сателлитизм) при больших лейкоцитозах).
O Завышение количества тромбоцитов отмечается при большом количестве микроцитов и шизоцитов.
3. Особенности влияния различных факторов на результаты исследования крови
Изменения клеточного состава периферической крови наблюдается как при патологии, так и в различных физиологических состояниях организма. На показатели крови могут оказывать влияние физическая и эмоциональная нагрузка, сезонные, климатические, метеорологические условия, время суток, прием пищи, курение и т. д. Так при интерпретации результатов необходимо учитывать такие данные, как возраст, пол, активность пациента и положение его тела в момент взятие крови.
С точки зрения физиологии, «нормальными» величинами лабораторных показателей считают значения, определенные у тщательно обследованных групп пациентов среднего возраста без объективных признаков патологии. Показатели, нормальные для группы одного возраста, пола, условий обитания, режима использования и т.д. отражают влияние межиндивидуальных колебаний исследуемых величин и определяют нормативы.
Клеточные и химический состав крови не является постоянным, поскольку отражает количественные и качественный изменения, происходящие при непрерывной смене физиологических процессов в организме: смена физической активности и покоя, приема пищи. Смена сна и бодрствования, влияние биологических ритмов. Эти факторы влияют на индивидуальные колебания показателей крови и соответствуют форме и степени реактивности организма каждого пациента.
Регулярные изменения состава крови наблюдаются в течение суток — суточные ритмы. Хорошо изучены суточные колебания содержания электролитов, стероидов, фосфатов, липидов, сахара, холестерина, кортизола и некоторых других показателей. Для ограничения влияния суточных вариаций на результаты анализа необходимо всегда брать пробы в одно и тоже время дня.
Чрезмерное возбуждение пациента во время фиксации и взятии крови может приводить к изменению показателей кислотно-щелочного равновесия, сахара, многих гормонов, количества эозинофилов и лимфоцитов. Значительные сдвиги активности ферментов связаны с физической нагрузкой. В зависимости от положения тела в пространстве варьируют показатели белка, кальция, калия, альбумина, аспартатаминотрансферазы, кислой и щелочной фосфатаз, фосфора и холестерина.
Еще более возрастает роль лечебных мероприятий, располагающих арсеналом средств интенсивного воздействия физических (тепловые процедуры, разряды тока, ультрафиолетовое облучение, воздействие УВЧ), химических (лекарственные препараты), или биологических (сыворотки, вакцины, аутогематерапия) факторов. Особым фактором воздействия является оперативное вмешательство, которое, как и любая травма приводит к закономерным неспецифическим изменениям метаболизма, носящим циклический характер.
Большинство современных лечебных средств влияет на результаты лабораторных исследований за счет либо фармакологической (в организме), либо технологической (при анализе пробы) интерференции. К механизмам фармакологической интерференции, или, говоря иначе, наложению изменений за счет лекарственных веществ на показатели данного состояния организма можно отнести:
а) изменение интенсивности патологического процесса;
б) побочное действие на деятельность различных органов и систем;
в) общий токсический эффект при передозировке или кумуляция;
Технологическая интерференция лекарства или его метаболитов проявляется во время лабораторного исследования, т.е. ее можно воспроизвести, добавляя определенное вещество к пробе сыворотки крови. Влияние технологической интерференции может носить физический, химический или биологический характер, когда, например, она оказывает воздействие на клеточный состав крови.
4. Информативность и достоверность гематологических тестов
С диагностической точки зрения предметом исследования крови для получения информации о состоянии организма служат:
а) структурные характеристики — форма и строение клеток, наличие химических соединений определенной структуры;
б) количественные характеристики — размеры и соотношения структурных компонентов клеток, число определенных клеточных элементов, их соотношение, концентрация химических соединений;
в) функциональные характеристики — осуществления цикла развития и созревания клеток, кругооборота и превращения химических веществ.
Для определения достоверности полученных результатов лабораторных исследований они должны быть выражены в цифровой форме, по меньшей мере в двоичной системе ответов -да, нет-, используемой в качественной оценке проб. Однако в гематологии все еще значительное распространение имеют словесные формы описания формы, цвета, плотности и гомогенности окраски клеток и их компонентов, соотношения их размеров. С развитием и совершенствованием методов исследования, использования цитометрических и цитофотометрических устройств объективность подученных результатов возрастает.
Использование лабораторных показателей для выявления патологии состоит в обнаружении отличия между показателями крови исследуемого и их значениями в норме. При этом необходимо учитывать величину изменчивости биологических систем и колеблемость их параметров в границах гомеостаза в ответ на внешние и внутренние факторы воздействия.
Данные лабораторного исследования являются случайной величиной, так как подвержены влиянию следующих факторов:
1) биологических, определяющих биологическую вариацию результатов лабораторных исследований в пределах нормальных величин;
2) диагностических и лечебных мероприятий, проводимых обследуемому, включая реакцию животного на фиксацию, манипуляции иди присутствие исследователя;
3) условия взятия, хранения и транспортировки биологической пробы, влияние консервантов и антикоагулянтов — доаналитическая вариация;
4) условия лабораторного анализа: ошибки метода, реактивов, приборов, лаборантов — аналитическая вариация;
5) патологических, определяющих отклонения результатов гематологических исследований за пределы нормальных величин — патологическая вариация.
Как случайные величины результаты лабораторных исследований крови образуют вариационный ряд с характерным для него расположением большинства величин вблизи его центральной части и рассеиванием к краям ряда, создавая определенное распределение, В связи с тем, что очень многие эмпирические распределения биологических признаков, характеризующихся непрерывной вариацией, приближаются к нормальному распределению, этот вид распределения занимает важнейшее место в биологической статистике.
При многократном повторном исследовании, когда имеют место в основном аналитические факторы вариации (см. условие 4.), результаты анализов обычно подчиняются закону нормального распределения. Биологические данные, то есть признаки в популяции здоровых и больных, испытывающие влияние биологических факторов вариации, могут не подчиняться закону нормального распределения. В таком случае для статической обработки результатов может быть уместным их преобразование в логарифмы и получении логарифмического нормального распределения.
гематологический тест кровь клетка
Для подсчета и анализа клеток крови используют ручные микроскопические методы и гематологические счетчики разного уровня автоматизации. В настоящее время необходимо внедрение технологий автоматического изучения клеточного состава крови, для того чтобы добиться высокого качества и точности исследований, исключая ошибки, зависящие от работы лаборантов. Клинические лаборатории нуждаются в разработке новых более совершенных методов. За последние 15 лет произошло существенное развитие технологий и аппаратуры для автоматического исследования клеток.
В некоторых странах мира автоматический анализ крови почти полностью заменил ручные и полуавтоматические.
Список используемой литературы
1. Александровская О.В., Радостина Т.Н., Козлов Н.А. Цитология, гистология и эмбриология. — М: Агропромиздат, 1987 — 448 с.
2. Грин Н. , Стаут У., Тейлор Д. Биология. — М: Мир, 1990. — Т. 3, №2. — С. 193 с.
3. Клиническая лабораторная аналитика //под ред. Меньшикова В.В. — М: 1999. — т 2.
4. Луговская С.А., Морозова В.Т., Почтарь М.Е., Долглов В.В. Лабораторная гематология. — М: Юнимед-пресс, 2002. — 115 с.
5. Луговская С.А. Лабораторная гематология. — М: Лаборатория, 2001 — № 2 2 3 с.
6. Луговская С.А. и др. Лабораторная диагностика. С.А. Луговская [Морозова В.Т.,]. — М.: Юнимед-пресс, 2002
7. Медицинские лабораторные технологии (в 2 томах). Том 1. под редакцией А.И. Карпищенко.
8. Назаренко Г.И., Кишкун А.А. Клиническая оценка результатов лабораторных исследований. / Г.И. Назаренко [Кишкун А.А.]. — М.: Медицина, 2006.
9. Кишкун А.А. Руководство по лабораторным методам диагностики / А.А. Кишкун. — М.: ГЭОТАР-Медиа, 2007.
10. Козинц Т.И., Макарова В.А. Исследование системы крови в клинической практике Т.И. Козинц [Макарова В.А.]. — М.: Триада-Х, 1998.
НОРМЫ (РЕФЕРЕНТНЫЕ ВЕЛИЧИНЫ) ЛАБОРАТОРНЫХ ПОКАЗАТЕЛЕЙ
источник
Гемоглобин (Hb) – молекула, с помощью которой переносится кислород. Она расположена внутри зрелых эритроцитов, лишенных ядер. Клетки получают кислород из альвеол легких, переносят его органам к клеткам-мишеням. От них получают углекислый газ, и переносят его обратно в легочную систему. Без этого действия невозможна жизнь человека. Существуют различные состояния, при которых гемоглобин может повышаться или снижаться. Для диагностики используют различные лабораторные методы определения функции соединения гемоглобина. Их подбирает врач индивидуально для каждого пациента.
У взрослого человека норма концентрации Hb зависит от пола:
- женщины 11-14г/% или 110-140 г/л;
- мужчины 12-16 г/% или 120-160 г/л.
Для мужчин норма более завышена, так как они имеют большую мышечную массу, по сравнению с женщинами.
Снижение концентрации гемоглобина наблюдается при следующих состояниях и заболеваниях:
- сниженная концентрация эритроцитов в следствии железодефицитной, серповидно-клеточной анемии;
- недостаточное количество веществ, которые влияют на продукцию эритроцитов (фолиевая кислота, витамин B12);
- заболевание красного костного мозга.
Повышенная концентрация Hb наблюдается при следующих состояниях и заболеваниях:
- повышенная продукция эритроцитов при заболевании красного костного мозга, злокачественных новообразованиях;
- компенсаторное повышение количества эритроцитов вследствие сердечно-сосудистых и легочных заболеваний;
- снижение количества плазмы крови вследствие чего число форменных элементов повышается в 1 л биологической жидкости.
Гемоглобин появляется в эритроцитах после утраты ядра и приобретении зрелости клетки. Местом утилизации красных кровяных клеток и Hb является селезенка. Жизненный цикл 1 клетки совместно составляет 120 дней. После гибели в кровь выделяется железо, которое поставляется в красный костный мозг. С помощью этого элемента продуцируются новые красные кровяные тельца.
Существуют следующие методы анализа гемоглобина в биологической жидкости:
После использования соответствующей методики чаще всего применяют полуавтоматический анализатор, который измеряет спектр длины волны молекулы Hb.
Подсчет показателей осуществляется не только в крови, но и в моче, так как в мочевыделительной системе возможны небольшие или значительные кровотечения.
Полуавтоматический гематологический анализатор полностью исключают реставрации врачебные ошибки в отчете необходимого значения. Но прибор не сможет увидеть и распознать нарушение различных параметров.
Ручной подсчет основывается на применении реактива и биологической жидкости. Метод не подсчитывает число клеток, а определяется их присутствие или отсутствие. Подходит для мочи
Унифицированная методика – способы измерения показателей, применяемые в большинстве лаборатории. Являются точными, быстрыми, практичными. Для Hb это гемицианидный метод с фотоколориметрическим подсчетом. Позволяет выявить точное количество показателя с помощью подсчета длины волны на специализированном полуавтоматическом приборе.
Второй унифицированной методикой является гимехромный способ. Его принцип тот же, но используются более качественные реактивы, которые не приносят вреда здоровью врачей.
У гемоглобина имеется множество форм, поэтому рассчитать длину его волны очень сложно. Для упрощения подсчета применяют специализированные химические вещества, которые переводит его в метгемоглобин.
Для получения точных результатов необходимо использовать трансформирующий раствор, специализированные измерительные пробирки, фотоэлектроколориметр. Hb имеет длину волны 540 м. Именно в таком пределе прибор подсчитывает заданный показатель.
Полученные данные подставляют в формулу, которая переводит общее количество показатели в граммы на литры (г/л).
Важно! На данный момент метод определения концентрации гемоглобина в крови используется редко, так как применяемые реактивы опасны для жизни и здоровья в врачей-лаборантов. При нарушении правил приготовления могут возникнуть ожоги кожных покровов и слизистых оболочек.
Читай подробно о гемиглобинцианидном методе в отдельной статье!
С помощью методики Hb переводится в циангемоглобин с помощью реактивов, которые полностью безопасны для человека. Для этого используют цианистые соединения (натрий додецилсульфат, лаурилсульфат).
Образуется гемихром, который подсчитывается при длине волны 540 нм. Полученные данные подставляют в формулу для перевода показателя в г/л.
Для проведения анализа используют капиллярную и венозную кровь. В биологическую жидкость человека добавляют трансформирующий раствор. С помощью него происходит преобразование всех форм Hb в метгемоглобин.
В пробирку наливают 5 мл реагента и 20 мкл биологической жидкости. Выжидают 10 минут, пока произойдет реакция. Полученную жидкость заливают в специальную кювету, фотоэлектроколориметр пропускает через нее лучи, подсчитывает элементы в области длины волны, равной 543 нм. Содержание Hb рассчитывается по формуле с помощью полученных показателей.
Определение количества гемоглобина по методу Сали редко применяется в клинических учреждениях, так как существуют более совершенные способы.
Получают биологическую жидкость человека, в которую добавляют хлористоводородная кислоту. Раствор тщательно перемешивают. Это позволяет Hb перейти в другую форму – солянокислый гематин. Добавляют дистиллированную воду до тех пор, пока окрашивание не будет идентичным с контрольной пробиркой (коричневый цвет).
На нижнем мениске пробирки будет стоять цифра, которая указывает на содержание показателя в 100 г крови. Для вычисления концентрации в 1 литре, показатели умножают на 10. Процентное содержание Hb вычисляется с помощью пропорции:
- А%=Х
- Х=А×100/16,7
- Х – определяемый показатель,
- А – полученное число гемоглобина с помощью гемометра,
- 16,7 – процентное количество гемоглобина в контрольной пробе.
Наиболее точным методом определения гемоглобина является использование спектрофотометра. Он определяет только 1 из форм гемоглобина, улавливая длину его волны. В крови человека существуют различные формы Hb:
- Оксигемоглобин;
- Дезоксигемоглобин;
- Карбоксигемоглобин;
- Метгемоглобин.
Для исследования с помощью спектрофотометра необходим перевод показателей только в 1 из форм. Для этого применяют различные реактивы. Показатель окрашивается определенным цветом (красный, зеленый). Его длину волны улавливает прибор, подсчитывает все элементы в заданной траектории.
Аммиачный метод количественного определения гемоглобина соответствует предыдущим способам. Разницу составляет использование аммиака в концентрации 0,04%. Проба должна настояться, чтобы произошла реакция перехода всех форм Hb в одну. Ее рассчитывают с помощью полуавтоматического анализатора в виде спектрофотометра. Раствор помещают в кювету, устанавливают в прибор. Рассчитывают показатель на длине волны 543 нанометров.
Существует 4 разновидности исследования мочи. Каждая из них отличается применяемыми реактивами. Для исследования собирают только свежую порцию урины. Если она настоится, Hb превратиться в медгемоглобин, Поэтому реакция будет невозможна. Урину подготавливают. Для этого к ней добавляет 2 мл уксусной кислоты и 5 мл диэтилового эфира.
- Реакция с гваяковой кислотой. Разводят щепотку кислоты, добавляют 3 мл этанола 96%. Добавляют 8-10 капель получившейся жидкости к 8-10 каплям разведенной урины. Если Hb присутствует в образце, он окрашивается в синий цвет.
- Реакция с амидопирином. К 2-3 мл разведенной урины добавляют 10 капель раствора амидопирина и 10 капель 3% перекиси водорода. Если Hb присутствует, урина окрашивается в фиолетовый цвет.
- Реакция с бензидином. В пробирку добавляют 6 капель бензидина, 6 капель 3% перекиси водорода,4 капли чистой урины. Если Hb присутствует, получившаяся жидкость окрашивается в зеленый цвет.
- Использование тест-полосок, таблеток. Они содержат специализированные реактивы в готовом виде. Полоски опускают в мочу, достают, оценивают цветовую шкалу. Таблетки полностью растворяют в биологической жидкости человека. Индикаторная шкала подписана на упаковке.
Наиболее точным методом определения показателя считается фотоколориметрический с использованием гемихромного разведения. С помощью него снижается риск врачебной ошибки. Прибор автоматически подсчитывает показатель. Здесь важно правильно подготовить приборы, пробирки, кюветы, настроить аппарат. Методика безопасна для лаборанта.
В определении Hb в моче наиболее информативным является использование тест-полосок. Здесь полностью исключается риск неправильного разведения реактивов.
Определение гемоглобина является важным информативным тестом. Можно определить кровотечение в мочевыводящих путях, состояние сердечно-сосудистой и легочной системы. С помощью методов вовремя выявляются различные виды анемии при низких концентрациях гемоглобина. После получения данных рекомендуется обратиться к лечащему врачу. Он расшифрует полученный результат, выявит нормы и отклонения, назначит лечение.
Екатерина Беликова, врач лабораторной диагностики, специально для Mirmam.pro
источник
Анализ крови на гемоглобин — необходимый этап диагностики различных заболеваний. По результатам только одного анализа крови на гемоглобин невозможно поставить точный диагноз, но определение гемоглобина выявит возможные нарушения в деятельности организма и укажет на необходимость дополнительного обследования.
Гемоглобин (HGB, hemoglobin). Гемоглобин — сложный белок в составе эритроцитов, состоящий из 2х частей: белка (глобин) и соединения железа (гема). Именно атомы железа (гема) делает кровь красной. Гемоглобин участвует в процессе транспорта кислорода и углекислого газа между легкими и клетками других органов, поддерживает рН крови. При недостатке гемоглобина в крови затрудняется перенос кислорода гемоглобином. В результате клетки не получают достаточно кислорода и в них нарушается обмен веществ и функции.
Физиологические формы гемоглобина:
1) оксигемоглобин (HbО2) — соединение гемоглобина с кислородом образуется, преимущественно, в артериальной крови и придает ей алый цвет (кислород связывается с атомом железа посредством координационной связи);
2) восстановленный гемоглобин или дезоксигемоглобин (HbH) — гемоглобин, отдавший кислород тканям;
3) карбоксигемоглобин (HbCO2) — соединение гемоглобина с углекислым газом; образуется, преимущественно, в венозной крови, которая вследствие этого приобретает темно-вишневый цвет.
Патологические формы гемоглобина:
1) карбгемоглобин (HbCO) — образуется при отравлении угарным газом (СО), при этом гемоглобин теряет способность присоединять кислород;
2) метгемоглобин — образуется под действием нитритов, нитратов и некоторых лекарственных препаратов (происходит переход двухвалентного железа в трехвалентное с образованием метгемоглобина- HbMet).
Анализ крови на гемоглобин — необходимый этап диагностики различных заболеваний. По результатам только одного анализа крови на гемоглобин невозможно поставить точный диагноз, но определение гемоглобина выявит возможные нарушения в деятельности организма и укажет на необходимость дополнительного обследования.
Содержание гемоглобина в крови у мужчин выше, чем у женщин. Гемоглобин у ребенка до 1 года понижен. У детей первого года жизни наблюдается физиологическое снижение концентрации гемоглобина.
Возможные ошибки измерения
Повышение уровня:
Увеличение концентрации гемоглобина наблюдается при сгущении крови или является результатом повышения образования эритроцитов.
Повышение гемоглобина в крови происходит после физической нагрузки, у альпинистов, у летчиков (после высотных полетов), у жителей высокогорья. Повышенный уровень гемоглобина в крови может возникнуть даже после пребывания на свежем воздухе.
1. Первичные и вторичные эритроцитозы;
2. Врожденные пороки сердца;
3. Сердечно-легочная недостаточность;
4. Сгущение крови (при дегидратации, ожогах, упорной рвоте, кишечной непроходимости);
5. Первичной и вторичной эритремии.
Снижение уровня:
Состояние организма, при котором происходит снижение гемоглобина в крови, называется анемией.
Патологическое снижение содержания гемоглобина в крови (анемия) может быть следствием повышенных потерь гемоглобина при различных кровотечениях, результатом ускоренного разрушения (гемолиза) эритроцитов, нарушением образования эритроцитов или других причин. Низкий гемоглобин возникает вследствие переливания крови.
Анемия может быть как самостоятельным заболеванием, так и симптомом какого-либо общего хронического заболевания (анемия хронических заболеваний). Как самостоятельное заболевание анемии развиваются при недостатке железа, необходимого для синтеза гемоглобина, при дефиците витаминов, участвующих в образовании эритроцитов (преимущественно витамина B12, фолиевой кислоты), вследствие повышенного разрушения эритроцитов в периферическом русле (гемолитические анемии) или нарушения образования клеток крови в костном мозге при специфических гематологических заболеваниях.
Зачастую происходит понижение гемоглобина у беременных женщин. При беременности гемоглобин обычно понижается при нехватке железа, поскольку суточная потребность в железе беременных женщин увеличивается. Если обычно человеку достаточно 5-15 мг железа в день, то беременной женщине потребуется 15-18 мг. Низкий гемоглобин беременных может отрицательно отразиться на здоровье будущей матери, вызвать преждевременные роды или задержку роста плода.
1. Анемии различной этиологии (основной симптом).
2. Гипергидратация (увеличение объема циркулирующей плазмы вследствие детоксикационной терапии, ликвидация отеков и т.д.).
Референсные значения:
Мужчины: 13.7 — 17.5 г/дл
Женщины: 11.2 — 15.7 г/дл
Кровь на 40-45 % состоит из форменных элементов (эритроцитов, тромбоцитов, лейкоцитов) и на 55-60 % из плазмы.
Гематокрит (в гематологических анализаторах) показывает какую часть объема пробы крови составляет объем осажденных эритроцитов в процентах. Т.е. сумма объемов эритроцитов в единице объема крови (не путать с общим количеством эритроцитов). Например, гематокрит равный 40%, означает, что в 100 мл крови содержится 40 мл осажденных эритроцитов.
Исследование гематокрита проводится изолированно или как часть общего анализа крови. Величина гематокрита зависит от количества и объёма эритроцитов. Изменения гематокрита не всегда коррелируют с изменениями общего количества эритроцитов.
Используется для оценки состояния эритроцитарной системы в целом при различных заболевания: состояниях, связанных с изменением объема циркулирующей крови, анемиях, эритроцитозах, заболеваниях желудочно-кишечного тракта, сердечно-сосудистой патологии, онкологических процессах а также служит ориентиром для суждения о гемоконцентрации и гемодилюции.
Величина гематокрита не является показательной при оценке степени анемии непосредственно после потери крови или гемотрансфузии. Так как за счет сгущения крови гематокрит может быть нормальным или даже высоким, хотя, вследствие потери крови, общее число эритроцитов может значительно снижаться. Следует иметь в виду, что при гемодилюциях гематокрит снижается.
Возможные ошибки измерения
Выраженная агглютинация эритроцитов может привести к получению неправильных значений гематокрита, т.к. агглютинаты эритроцитов могут восприниматься прибором как лейкоциты и не учитываться при расчете HCT. В таких случаях рекомендуется определение гематокрита на гематокритной центрифуге.
Повышение гематокрита наблюдается при реактивных и опухолевых эритроцитозах, уменьшении объема циркулирующей плазмы (ожоговая болезнь, дегидратация). Снижение гематокрита имеет место при анемиях, беременности (второй триместр), гипергидратации.
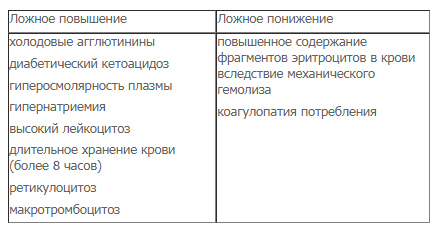
При гипергликемии и диабетическом кетоацидозе отмечается гиперосмолярность плазмы крови. При разведении крови in vitro изотоническим раствором происходит быстрое набухание эритроцитов, что и вызывает завышение HCT. В этих случаях определение гематокрита на гематокритной центрифуге является более точным.
Показатели гематокрита и гемоглобина являются важными параметрами общего состояния здоровья, повышение которых, например, у спортсменов может свидетельствовать о приеме препаратов, вызывающих экзогенную стимуляцию костного мозга (введение эритропоэтина).
Факторы, приводящие к повышению результата:
1. Гемоконцентрация вследствие наложения жгута более чем на 1 мин (обычно вызывает повышение гематокрита на 2,5-5%).
2. Препараты, провоцирующие развитие апластической анемии или вызывающие гемолиз в случае дефицита глюкозо — 6 фосфатдегидрогеназы.
Факторы, приводящие к снижению результата:
1. При взятии крови в положении лежа
2. Гемодилюция при взятии крови из руки, в которую производится внутривенная инфузия.
3. Лекарственные средства: α-интерферон, тромболитики (например, алтеплаза, антистреплаза, стрептокиназа)
У новорожденных гематокрит примерно на 10% выше, а у маленьких детей — примерно на столько же ниже, чем у взрослого человека.
Повышение уровня:
1. Первичный эритроцитоз (эритремия) — до 65%;
2. Симптоматические эритроцитозы (врожденные пороки сердца, лёгочная недостаточность, некоторые гемоглобинопатии, новообразования почек, сопровождающиеся усиленным образованием эритропоэтина, гидронефроз и поликистоз почек) — до 50-55%;
3. Гемоконцентрация (уменьшение объема циркулирующей плазмы) при ожоговой болезни, перитоните, дегидратации организма (при выраженной диарее, неукротимой рвоте, повышенной потливости, диабете);
5. Чрезмерная физическая нагрузка или возбуждение;
6. Пребывание на больших высотах.
Снижение уровня:
2. Увеличение объема циркулирующей крови:
— беременность (особенно вторая половина)
Референсные значения:
Мужчины: 40.1 — 51.0 %
Женщины: 34.1 — 44.9 %
Эритроциты высокоспециализированные безъядерные клетки крови дисковидной формы, содержащие гемоглобин, основной функцией которых является транспорт кислорода из легких к тканям и углекислоты от тканей в легкие.
Эритроциты образуются в красном костном мозге из стволовых клеток. Для нормального развития эритроцитов необходимы витамин B12, фолиевая кислота и достаточное поступление железа. Образование эритроцитов стимулируется эритропоэтином, который вырабатывается в почках. Уровень эритропоэтина повышается при гипоксии тканей. Средний срок жизни эритроцитов в сосудистом русле — 120 дней. У новорожденных размер эритроцитов несколько больше, чем у взрослых. Старые клетки разрушаются в ретикуло-эндотелиальной системе и селезенке, а железо гемоглобина используется для образования новых эритроцитов. За один день обновляется около 1% эритроцитов.
Эритроцитарные параметры:
RBC (red blood cells) — количество эритроцитов крови.
Определение количества эритроцитов осуществляется путем вычитания из общего числа клеток в цельной крови тромбоцитов и лейкоцитов. Для исключения из счета тромбоцитов, которые имеют существенно меньшие размеры по сравнению с эритроцитами и лейкоцитами, используются пороговые значения. Считаются все частицы размером более 36 фл. Коэффициент вариации для данного параметра составляет 1-2%, а в некоторых приборах — менее 1%.
Следует отметить, что иногда лейкоциты включаются в подсчет вместе с эритроцитами, но их влияние в норме незначительно, т.к. количество лейкоцитов существенно меньше (на 3 порядка — несколько тысяч) числа эритроцитов (несколько миллионов). В случаях гиперлейкоцитоза ошибка измерения эритроцитов возрастает.
Увеличение количества эритроцитов выше нормальных показателей называется эритроцитозом, снижение количества эритроцитов (и гемоглобина) — анемией.
Возможные ошибки измерения
Присутствие криоглобулинов может вызывать увеличение показателей WBC, RBC или PLT и концентрации HGB. В таких случаях следует прогреть образец крови до 37°С в течение 30 минут и немедленно провести измерение образца. Криоглобулинемия может наблюдаться у больных миеломой, макроглобулинемией Вальденстрема, злокачественными новообразованиями, лейкозом, лимфопролиферативными и аутоиммунными заболеваниями, вирусным гепатитом, сахарным диабетом.
Агглютинация эритроцитов может привести к занижению показателей RBC, увеличению MCV. Это можно проверить по повышенным значениям MCH и MCHC.
Увеличение количества эритроцитов называется эритроцитозом (полиглобулией). Снижение количества эритроцитов (и гемоглобина) — анемией.
Физиологический эритроцитоз отмечается у новорожденных в первые дни жизни, при стрессовом состоянии, повышенной физической нагрузке, усиленном потоотделении, голодании. Количество эритроцитов может физиологически несколько снизиться после еды, в период между 17.00 и 7.00, а также при взятии крови в положении лежа.
Повышение уровня:
3. Водянка почечных лоханок;
4. Влияние кортикостероидов;
5. Болезнь и синдром Кушинга;
7. Эритремия, или болезнь Вакеза — один из вариантов хронических лейкозов
(первичный эритроцитоз);
- абсолютные — при гипоксических состояниях (хронические заболевания легких, врожденные пороки сердца, высотной болезни), стимуляции эритропоэза (гипернефрома, болезни Иценко-Кушинга, гемангиобластома мозжечка), когда происходит стимуляция эритропоэза и рост числа эритроцитов;
- относительные — при сгущении крови (избыточная потливость, рвота, диарея, ожоги, нарастающие отеки, асцит и прием диуретиков), когда уменьшается объем плазмы при сохранении количества эритроцитов.
Снижение уровня:
3. Снижение интенсивности образования эритроцитов в костном мозге;
4. Ускоренное разрушение эритроцитов;
6. Дефицитные анемии разной этиологии — в результате дефицита железа, белка,
витаминов;
9. Метастазы злокачественных опухолей.
Референсные значения:
Мужчины — (4.63-6.08) х 106/мкл
Женщины — (3.93-5.22) х 106/мкл
В старых анализах указывали: микроцитоз, нормоцитоз, макроцитоз.
В моделях современных гематологических счетчиков осуществляется автоматическое измерение объема каждого эритроцита; таким образом, значение MCV в этих приборах представляет собой среднюю величину объема всех измеренных эритроцитов.
Показатель MCV имеет диагностическое значение при оценке микро-, нормо- и макроцитоза, также его используют в расчетах среднего содержания и концентрации гемоглобина в эритроцитах. На основании значения MCV различают анемии микроцитарные, нормоцитарные и макроцитарные
В норме средний объем эритроцита составляет от 80 до 100 фл. Эти значения MCV характерны для нормоцитов. Если величина MCV меньше 80 фл, говорят о микроцитозе, если больше 100 фл — о макроцитозе. На основании значения MCV различают анемии микроцитарные, нормоцитарные и макроцитарные.
Микроцитоз характерен для железодефицитных анемий, гетерозиготных талассемий; макроцитоз — для B12- и фолиеводефицитных анемий. Апластическая анемия может быть нормо- и макроцитарной. Количественный показатель объема эритроцитов, более точный параметр, чем визуальная оценка размера эритроцитов при просмотре мазка под микроскопом.
Однако следует учитывать, что данный параметр является усредненной величиной, и при выраженном анизоцитозе, а также при наличии большого количества эритроцитов с измененной формой, он не отражает в достаточной степени истинный размер клеток.
MCV может иметь нормальное значение при наличии у пациента одновременно выраженного макро- и микроцитоза, при большом количестве аномальных эритроцитов (например, при серповидно-клеточной анемии; выраженном пойкилоцитозе). В этом случае особую диагностическую важность приобретает анализ эритроцитарной гистограммы и морфология клеток в мазках крови.
Возможные ошибки измерения MCV
При наличии агглютинации эритроцитов прибор воспринимает их как одну большую клетку, если размер их меньше верхнего порога эритроцитарного канала, что приводит к увеличению MCV. Сохранение крови in vitro и измерение таких проб при 37oС способствует получению правильных результатов.
Ложное завышение MCV может происходить в случае присутствия холодовых агглютиатов (они воспринимаются прибором как одна большая клетка), при гипергликемии и диабетическом кетоацидозе вследствие гиперосмолярности плазмы (из-за чего при разведении in vitro происходит быстрое набухание эритроцитов).
Относительное снижение MCV может наблюдаться при повышенном содержании фрагментов эритроцитов вследствие механического гемолиза, коагулопатии потребления, присутствия гигантских тромбоцитов. Необходимо учитывать, что MCV может иметь нормальное значение при наличии у пациента одновременно выраженного макро- и микроцитоза, поэтому MCV всегда следует рассматривать в совокупности с эритроцитарной гистограммой и показателем RDW.
Повышение уровня:
1. Мегалобластная анемия (В12-дефицитная, фолиеводефицитная);
2. Макроцитоз при апластической анемии, гипотиреозе, болезнях печени, метастазах
злокачественных опухолей; \
3. Сфероцитарные аутоиммунные гемолитические анемии;
4. Курение и употребление алкоголя.
Снижение уровня:
1. Гипохромные и микроцитарные анемии (анемия при дефиците железа, хронических
патологических состояниях, талассемиях);
2. Некоторые виды гемоглобинопатий;
Клинико-диагностическое значение при анемиях:
Значение МСV 80 фл и 100 фл
Макроцитарные и мегалобластные анемии:
1. Дефицит витамина В12, фолиеводефицитной кислоты
Анемии, которые могут сопровождаться макроцитозом:
1. Миелодиспластические синдромы
Референсные значения:
Мужчины: 79.0-92.2 фл
Женщины: 79.4-94.8 фл
MCH — среднее содержание гемоглобина в отдельном эритроците выражается в абсолютных единицах массы — пикограммах (1 пг = 1х10-12г).
Его определяют путем деления концентрации гемоглобина в 1 л на число эритроцитов в том же объеме: MCH = HGB/RBC.
MCH по клиническому значению аналогичен цветовому показателю, к которому и сейчас традиционно прибегают многие специалисты. Цветовой показатель, как известно, — величина относительная и, по современным данным, является отношением количества гемоглобина в одном эритроците пациента к нормальному его содержанию (принятому равным 33,3).
Таким образом, чтобы перейти от значения MCH к более привычному цветовому показателю, достаточно разделить MCH на 33,3. Изменения MCH лежат в основе разделения анемий на нормохромные (MCH — 27-31 пг), гипохромные (MCH менее 27 пг) и гиперхромные (MCH более 31 пг). Снижение MCH наблюдается при анемиях обусловленных нарушеннием синтеза гемоглобина (железодефицитной анемии, порфирии), повышение — при макроцитарных и особенно мегалобластных анемиях.
MCH — более объективный показатель, чем цветовой показатель, который не отражает синтез гемоглобина и его содержание в эритроците, а во многом зависит от объема клетки.
Необходимо помнить, что снижение или повышение MCH не всегда свидетельствует о гипо- или гиперхромии эритроцитов. Например, при микроцитарной анемии среднее содержание гемоглобина в эритроцитах будет снижено вследствие уменьшения объема эритроцитов, в то время как их нормохромная окраска будет сохранена. В связи с этим показатель MCH сравнительно редко используется в клинической практике для характеристики анемий.
Возможные ошибки измерения.
Параметр MCH является расчетным, поэтому к ложноповышенным результатам приводят все факторы, влияющие на увеличение значений гемоглобина и снижение количества эритроцитов. Ложнопониженные результаты MCH получаются вследствие ошибок, связанных с неправильным определением числа эритроцитов (завышения их количества) и занижения концентрации гемоглобина.
Повышение уровня:
1. Мегалобластная анемия (В12-дефицитная, фолиеводефицитная).
2. Макроцитоз (апластическая анемия, гипотиреоз, болезни печени, метастазы злокачественных опухолей).
Снижение уровня:
1. Гипохромные анемии (анемия при дефиците железа, хронических патологических состояниях).
2. Некоторые виды гемоглобинопатий;
Референсные значения:
Мужчины: 25.7-32.2 пг
Женщины: 25.6-32.2 пг
Рассчитывается путем деления концентрации гемоглобина крови на гематокрит и умножения на 100. Вычисляется по формуле: MCHC = HGB (г/дл)/HCT (%) х 100 (г/дл).
Различия между MCH и МСНС заключаются в том, что MCH указывает на массу гемоглобина в одном эритроците и выражается в долях грамма, тогда как МСНС показывает концентрацию гемоглобина в одном эритроците, то есть соотношение содержания гемоглобина к объему клетки.
Он напрямую связан с синтезом гемоглобина и отражает насыщение эритроцита гемоглобином.
В отличие от MCH МСНС не зависит от клеточного объема и является чувствительным показателем нарушений гемоглобинообразования, в частности, при железодефицитных анемиях, талассемиях, некоторых гемоглобинопатиях (снижение МСНС). При В12- и фолиеводефицитной анемиях МСНС будет в норме, а гиперхромия в данном случае будет обусловлена увеличением объема эритроцитов.
При развитии заболеваний, сопровождающихся нарушением синтеза гемоглобина, МСНС снижается в последнюю очередь, когда истощаются компенсаторные реакции организма, поэтому пониженное значение этого параметра на фоне нормального содержания эритроцитов и гемоглобина может свидетельствовать о некорректно проведенном исследовании.
Предельная концентрация гемоглобина в эритроците (38 г/дл) тоже встречается довольно редко. Это связано со строением молекулы гемоглобина, растворимостью ее в воде и, соответственно, способом упаковки в эритроците.
Возможные ошибки измерения.
Поскольку параметр MCHC является расчетным, то к ложно завышенным результатам приводят все факторы, влияющие на завышение значений гемоглобина и занижение гематокрита (последний связан с измерением объема эритроцитов). Ложно пониженные результаты MCHС получаются вследствие неправильного определения MCV (завышения их значения) и занижения концентрации гемоглобина.
Повышение уровня:
1. Наследственная микросфероцитарная гемолитическая анемия;
2. Ложное завышение, свидетельствующее о технической ошибке при измерении;
Повышение МСНС больше 38 г/дл фактически быть не может, т.к. это значение является верхним пределом растворимости гемоглобина в воде (повышение концентрации гемоглобина выше физиологического может закончиться кристаллизацией его и гемолизом эритроцита). Поэтому повышение МСНС свидетельствует об:
а)ошибках на аналитическом этапе при измерении данной пробы (погрешности определения гемоглобина или среднего объема эритроцитов);
б)ошибках на преаналитическом этапе (частичный гемолиз эритроцитов).
Снижение уровня:
1. Асолютная гипохромия эритроцитов (например, при железодефицитных анемиях, талассемии);
2. Макроцитарные и особенно мегалоцитарные формы анемии (непропорционально большое увеличение объема эритроцита по сравнению с увеличением его насыщения гемоглобином);
3. Некоторые гемоглобинопатии.
Референсные значения:
Мужчины: 32.3-36.5 г/дл
Женщины: 32.2-35,5 г/дл
Распределение размеров эритроцитов — выраженная в цифрах величина, связанная со степенью анизоцитоза (различия объемов эритроцитов в популяции). Расчет этого показателя становится возможным благодаря использованию современных гематологических анализаторов, позволяющих автоматически определять объем каждого измеряемого эритроцита. По этому параметру анизоцитоз улавливается прибором значительно быстрее, чем при визуальном просмотре мазка крови.
В то же время, показатель RDW характеризует колебания объема клеток внутри популяции и не связан с абсолютной величиной объема эритроцитов. Поэтому, при наличии в крови популяции эритроцитов с измененным, но достаточно однородным размером (например, микроциты), значения RDW могут быть в пределах нормы. RDW целесообразно анализировать вместе с гистограммой распределения объемов эритроцитов и величиной MCV.
RDW-CV — относительная ширина распределения эритроцитов по объёму, коэффициент вариации т.е. процент отклонения объема эритроцитов от среднего значения в популяции (% разброса).
Рассчитывается как коэффициент вариации среднего объема эритроцитов по формуле:
RDW-CV = (SDх100%)/MCV
где SD — стандартное среднеквадратическое отклонение объема эритроцита от среднего значения. На этот показатель влияет MCV, поэтому как при микроцитозе, так и при макроцитозе отмечается тенденция к увеличению RDW-CV.
RDW-SD В гематологических анализаторах имеется еще один расчетный показатель RDW — это RDW-SD — относительная ширина распределения эритроцитов по объёму, стандартное отклонение, показывает разницу между максимальным и минимальным объемом эритроцита в популяции. Независим от MCV и представляет собой прямое измерение ширины эритроцитарной гистограммы на уровне 20% пика кривой. При этом высота пика RBC-гистограммы принимается за 100%. Клинически значимое значение RDW-SD > 60фл.
Оба показателя RDW определяют вариабельность эритроцитов по объему. Повышение RDW предполагает присутствие смешанной популяции клеток (нормоциты и микроциты или макроциты и нормоциты). Высокие значения RDW встречаются практически при всех типах анемий, а также при миелодиспластических синдромах, костно-мозговой метаплазии, метастазах опухолей в костный мозг.
Значительное увеличение RDW характерно для железодефицитных и сидеробластических анемий, тогда как нормальные или малоизмененные величины RDW (при MCV меньше 80 фл) чаще встречаются при талассемии и вторичных анемиях при различных хронических заболеваниях. При высоком значении RDW MCV становится малоинформативным в силу своей усредненности.
RDW-SD является более чувствительным показателем при наличии минорной популяции макроцитов или микроцитов, т.к. он измеряет нижнюю часть кривой распределения эритроцитов по объему (отображается уплощением и растягиванием эритроцитарной гистограммы). В тоже время этот показатель будет изменяться при высоком ретикулоцитозе в силу их большого объема, что расширяет основание кривой распределения эритроцитов. RDW-CV менее чувствителен к присутствию небольшой популяции микроцитов или макроцитов или ретикулоцитов, но лучше отражает общие изменения в размере эритроцитов при макроцитарной или микроцитарной анемии.
Анизоцитоз улавливается прибором значительно быстрее, чем при визуальном просмотре мазка крови, так как прибор измеряет непосредственно объем клеток, а морфолог под микроскопом видит клетку в плоскости и может пропустить начальные изменения объема. Кроме того, оценка степени анизоцитоза под микроскопом сопровождается целым рядом ошибок.
При высыхании в мазках диаметр эритроцитов уменьшается на 10-20%. В толстых препаратах он меньше, чем в тонких. Показатель RDW характеризует колебания объема клеток внутри популяции и не связан с абсолютной величиной объема эритроцитов. Поэтому при наличии в крови популяции эритроцитов с измененным, но достаточно однородным размером (например, микроциты), значения RDW могут быть в пределах нормы. В то же время при выраженном анизоцитозе эритроцитов показатель MCV, характеризующий средний объем всей клеточной популяции, является нормальным, а RDW будет повышенным.
Таким образом, сочетанное использование двух параметров — RDW и MCV — позволяет точнее характеризовать изменения в периферическом звене эритрона. RDW также может быть полезно при регистрации результатов гемотерапии при железодефицитной или мегалобластической анемии. По мере воспроизведения у пациентов новых, нормальных по размеру эритроцитов RDW сначала повышается, но затем снижается, когда клетки нормальных размеров составляют большинство
RDW вместе с МСV служит для дифференциации микроцитарных анемий. RDW следует анализировать вместе с гистограммой эритроцитов, которую представляют большинство современных гематологических анализаторов.
Повышение уровня:
2. Миелодиспластических синдромах
3. Метастазах новообразований в костный мозг
4. Железодефицитных анемиях
Клинико-диагностическое значение при анемиях:
Значение МСV> 80 фл, RDW в норме:
1. Анемии при хронических заболеваниях
Значение МСV>80 фл, RDW высокое:
1. Железодефицитные анемии
2. Сидеробластические анемии.опубликовано econet.ru.
Изменение показателей при наиболее часто встречающихся гематологических синдромах красной крови:
Если у вас возникли вопросы, задайте их здесь
P.S. И помните, всего лишь изменяя свое потребление — мы вместе изменяем мир! © econet
Понравилась статья? Тогда поддержи нас, жми:
источник
.jpg)



.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)