Антитела представляют собой белки, которые вырабатываются иммунными клетками. Они необходимо для борьбы с чужеродными микроорганизмами. В период беременности организм женщины уязвим ко многим инфекциям, а это влияет на развитие плода. Поэтому важно знать, присутствуют ли антитела в крови.
Анализ крови на антитела является одним из главных анализов во время беременности
Под антителами принято понимать клетки иммунитета, которые распознают и уничтожают чужеродные микроорганизмы. Это могут быть не только вирусы, бактерии, токсические вещества, но и клетки организма. Их формирование происходит из лимфоцитов, и являются своеобразной защитной реакцией.
В период беременности антитела могут вырабатываться против плода, так как напоминают собой чужеродное тело. Это происходит при несовместимости по резусу и группе крови. Обычно при беременности сдают анализы на антитела к TORCH-инфекциям. Это исследование на краснуху, герпес, цитомегаловирус и токсоплазмоз.
Существует несколько видов антител, каждый из которых относится к определенным антигенам: lgA, lgE, lgM, lgG, lgD.
Эти антитела выполняют определенную функцию. Благодаря анализу на антитела можно определить грибковую, вирусную или бактериальную инфекцию. Изменение количества антител дает информацию о том, изменения в организме являются защитной реакцией или они борются с инфекцией.
К тому же можно узнать, нужны ли дополнительные препараты для борьбы с инфекцией или иммунитет справится сам. При анализе крови определяют резус-фактор. Анализ на антитела помогает определить стадию течения заболевания и спрогнозировать лечение. Выработка антител в большом количестве происходит при попадании вируса или бактерии в организм. При столкновении чужеродных микроорганизмов с антителами у человека повышается температура, что свидетельствует о развитии воспалительного процесса.
Больше информации об анализе крови на антитела можно узнать из видео:
- Уровень lgА — 0,35-3,55 г/л
- Уровень lgG – 7,8-18,5 г/л
- Уровень lgM — 0,8-2,9 г/л
Если в результате исследования антитела lgM и lgG не обнаружены, т.е. отрицательны, то это говорит о том, что с инфекциями организм не встречался и заражение может произойти в любое время. В этом случае исследование проводится каждый месяц.
При положительном результате, т.е. присутствие в крови антител указывает на то, что женщина перенесла инфекцию недавно, до или во время беременности. Врач назначит дополнительное обследование, так как такое состояние может быть опасным для плода.
Положительный lgG и отрицательный lgM свидетельствует о перенесенной инфекции и на развитие плода это не повлияет.
Если в анализах lgG отрицательный, а lgM положительный, то инфицирование произошло в период беременности. В крови при исследовании антител к TORCH-инфекциям в норме lgM быть не должно. В медицинской практике АТ- lgG считается вариантом нормы.
При отсутствии lgG к вирусу краснухи или недостаточном уровне необходимо сделать прививку. Ее можно делать только при отрицательном уровне lgM. В крови будут присутствовать антитела к краснухе. После вакцинации беременеть можно спустя 2-3 месяца. Антитела к фосфолипидам в норме должны составлять меньше 10 Ед/мл.
Отклонение от нормы антител может влиять на нормальное развитие плода
При отрицательном резусе-крови у женщины и положительном у плода развивается резус-конфликт при попадании антител в кровоток малыша. Вследствие этого у ребенка может развиться желтуха, гемолитическая болезнь, анемия.
Резус-конфликт матери и плода может привести к нарушениям в работе головного мозга, сердца, из-за недостатка поступления кислорода во время вынашивания.
Гемолитическая болезнь может стать причиной нарушения функционирования органов у плода. При рождении у ребенка можно наблюдать увеличение в размере печени, селезенки. При гемолитической болезни у малыша выполняют переливание крови.
При обнаружении в крови антител следует установить причину их появления.
Чтобы определить степень риска для плода определяют титр антител на протяжении всего периода беременности. Таким образом можно обнаружить их концентрацию в 1 мм раствора.
- Если титр антител 1:4, то это указывает на резус-конфликтную беременность. Если титр антител значительно повышен 1:16, то в данном случае показано проведение амниоцентеза. При таком титре вероятность внутриутробной гибели плода. Проводится амниоцентез не ранее 26 недели беременности.
- Если титр составляет 1:64, то прибегают к досрочному родоразрешению путем кесарева сечения.
- Обнаружение в крови антител к токсоплазмозу на ранних сроках может привести к заражению плода этой инфекцией. В результате у ребенка поражается печень, селезенка, нервная система. Женщине предлагают сделать искусственное прерывание беременности. На поздних сроках вероятность передачи инфекции малышу составляет 70%, однако риск осложнений снижается.
- Наличие антител к краснухе в крови беременной является опасным для плода, так как поражается нервная ткань, сердце, ткани глаз. Если заражение произошло в начале беременности, то это показание к прерыванию беременности. Во втором и третьем триметре антитела серьезных последствий не вызывают. Ребенок может отставать в развитии, некоторые органы неправильно функционируют и т.д.
- Если у матери обнаружены антитела к цитомегаловирусной инфекции, то это может привести к гибели плода. В других случаях возможно рождение ребенка с врожденной патологией в виде водянки головного мозга, увеличении печени, пневмонии, порока сердца и др.
- При повышении антифосфолипидных антител развивается иммунная агрессия. Клетки иммунитета разрушают фосфолипиды, в результате чего развивается антифосфолипидный синдром. Данное состояние в период вынашивания ребенка очень опасно и может стать причиной выкидыша, кислородного голодания, отслойки плаценты и развития внутриутробных патологий. Все это связывают с нарушением кровообращения в плаценте.
Во избежание тяжелых последствий от резус-конфликтного состояния матери и ребенка необходимо пройти специальную программу Анти-Дгамма-глобулин.
После рождения у малыша обязательно берут кровь. При отрицательном резус-факторе у ребенка и матери вводится Анти-Дгамма-глобулин малышу.
Если женщина в период беременности получила удар в живот или упала, то при кровотечении и подтекании плаценты вводят гамма-глобулин. Антирезустный иммуноглобулин вводится беременной женщине на 7 месяце беременности и после родов на 3 сутки.
Важно своевременно сдавать анализы – не в период беременности, а до ее наступления. Так можно обезопасить себя и будущего малыша от возможных серьезных последствий.
источник
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Показания для иммунологического обследования: привычное невынашивание беременности неясного генеза; анэмбриония в анамнезе; предшествующая беременность с задержкой внутриутробного развития; внутриутробная гибель плода на любом этапе беременности; аутоиммунные заболевания и состояния; наличие в анамнезе тромбозов артериальных и венозных; тромбоцитопения; неудачи экстракорпорального оплодотворения (ЭКО).
Лечение антибиотиками, некоторые физиотерапевтические процедуры ведут к снижению показателей клеточного и гуморального иммунитета. Период, восстановления показателей иммунитета до исходного уровня различный от 3 до 6 месяцев, поэтому иммунологические исследования необходимо проводить до начала терапии.
Если снижены все параметры иммунитета, то лечение антибактериальными средствами необходимо сочетать с иммуномодулирующими средствами. Рекомендовать беременность можно только после того, как показатели клеточного и гуморального иммунитета будут восстановлены, так как адекватная иммунная реакция организма необходима для нормального течения беременности.
Тесты иммунологического обследования для пациенток с привычным невынашиванием беременности.
Иммунофенотипирование субпопуляций состава лимфоцитов периферической крови позволяет выявить отклонения от нормы и особенно оценить уровень активированных клеток, которые ответственны за продукцию провоспалительных цитокинов и аутоантител.
Различают 5 классов антител:
- IgM — первыми появляются в ответ на антигенную стимуляцию и эффективны в связывании и агглютинации микроорганизмов (антигенов). Они имеют более крупную молекулу чем другие иммуноглобулины и не проникают через плаценту к плоду.
- IgG — антитела, при иммунном ответе появляются вслед за IgM, проникают во внесосудистые пространства и через плаценту проникают к плоду.
- IgA — основные антитела, содержащиеся в секретах в кишечнике, легких,моче. Основная их функция — предотвратить проникновение антигенов с поверхности в ткани.
- IgE — в норме составляют менее 1/10000 всех сывороточных иммуноглобулинов, но при аллергии его содержание многократно увеличивается более чем в 30 раз, а содержание специфических IgE более чем в 100 раз.
- IgD — действуют на поверхности В-клеток, выполняя регуляторную функцию.
Определение иммуноглобулинов трех основных классов (A, M, G) необходимо при оценке иммунного статуса. Повышение уровня IgM наблюдается при первичной инфекции или при обострении персистентной вирусной инфекции. Низкий уровень IgA является основанием для отказа от использования иммуноглобулина в процессе лечения, так как возможны анафилактические осложнения. Наибольшее значение в акушерской практике имеет определение специфических антител к вирусным, паразитарным инфекциям.
Наличие иммуноглобулинов класса IgG, специфических к вирусу простого герпеса, цитомегаловирусу, токсоплазме означает, что пациентка встречалась в прошлом с этими антигенами и у нее есть иммунитет, и при активации вируса простого герпеса и/или цитомегаловирусной инфекции плод страдать тяжело не будет, а при наличии антител класса IgG к токсоплазме плод вообще болеть не будет этим заболеванием.
Наличие специфических IgM при отсутствии IgG означает, что имеет место первичное заражение. При наличии одновременно специфических IgM и IgG антител чаще всего имеет место обострение хронической вирусной инфекции. Возможно, что обострения нет, а есть длительная персистенция IgM антител.
Особое внимание следует уделять пациенткам у которых нет антител к таким инфекциям, которые при беременности могут вызвать тяжелое поражение плода — ВПГ, ЦМВ, токсоплазмоз, краснуха. Эти пациентки называются серонегативными. При контакте с инфекционным агентом впервые происходит инфицирование и соответственно выработка антител. Сначала появляются антитела класса IgM, происходит так называемая конверсия и пациентка из серонегативной становится серопозитивной по конкретной инфекции. В этом случае если инфекция вызывает пороки развития плода, чаще всего приходится беременность прерывать, а не сохранять, особенно если конверсия наблюдалась в I триместре.
Поэтому при определении вирусоносительства одновременно следует определить наличие и класс специфических антител.
Оценка интерферонового статуса представляется чрезвычайно важным моментом обследования.
Интерферон-у — группа белков, продуцируемых в ответ на вирусную инфекцию, а также под влиянием липолисахарина и др., продуцируются макрофагами ИФН-а, фибробластами ИФН-Р и Т-клетками (Th-1 хелперами) ИФН-у. Интерфероны стимулируют клетки к выделению белков, блокирующих транскрипцию информационной РНК вируса. Интерфероны более видоспецифичны, чем другие цитокины.
Высокий уровень интерферона в сыворотке нарушает нормальное развитие плацентации, ограничивая инвазию трофобласта и оказывая на эмбрион прямое токсического действие. Проводится оценка сывороточного интерферона, спонтанная ИФН реакция лейкоцитов, продукция лейкоцитами ИФН-а при индукции вирусом болезни Ньюкастла (ВБН), продукция альфа и бета ИФН на иммуномодуляторы для подбора наиболее эффективных индукторов для конкретной больной (неовир, полиоксидоний, циклоферон, ридостин, лорифан, имунофан, деринат, темурит); продукция лимфоцитами ИФН-у при индукции фитогемагглютинином (ФГА) конквалином (КонА), стафилококковым энтеротоксином (СЭА).
Дисбаланс системы интерферонов имеется практически у всех женщин с привычным невынашиванием, особенно при хронической вирусной инфекции и аутоиммунных нарушениях. Этот дисбаланс выражается резким повышением сывороточного интерферона или резком снижении продукции всех типов интерферона клетками крови в ответ на различные индукторы.
- Определение уровней провоспалительныхи регуляторных цитокинов проводится иммуноферментным анализом (Elisa) в сыворотке крови, слизи и клетках цервикального канала, супернатантах in vitro активированных лимфоцитов.
В настоящее время известно более 30 цитокинов. Традиционно, исходя из биологических эффектов, принято разделять:
- интерлейкины — регуляторные факторы лейкоцитов (их изучено 17);
- интерфероны — цитокины с преимущественно противовирусной активностью;
- факторы некроза опухоли, оказывающие иммунорегуляторное и прямое цитотоксическое действие;
- колониестимулирующие факторы — гемопоэтические цитокины;
- хемокины;
- факторы роста.
Цитокины различаются построению, биологической активности, происхождению, однако обладают рядом сходных признаков, характерных для этого класса биорегуляторных молекул.
Для функционирования системы цитокинов в норме характерны: индивидуальный характер образования и рецепция цитокинов; каскадный механизм действия; локальность функционирования; избыточность; взаимосвязанность и взаимодействие компонентов. В норме цитокины, образуемые при первичном иммунном ответе, практически не поступают в кровоток, не оказывают системных эффектов, т.е. имеет место локальный характер их действия.
Определение в периферической крови высоких уровней цитокинов всегда свидетельствует о нарушении принципа локальности функционирования цитокиновой сети, что наблюдается при интенсивных, длительно текущих воспалительных, аутоиммунных заболеваниях, сопровождающихся генерализованной активацией клеток иммунной системы.
Избыточность системы цитокинов проявляется в том, что каждый тип клеток иммунной системы способен продуцировать несколько цитокинов и каждая разновидность цитокинов можетсекретироваться различными клетками. Кроме того, для всех цитокинов характерна полифункциональность с сильным перекрыванием эффектов. Так, проявление общих и местных признаков воспаления обусловливает целый ряд цитокинов: il-1, il-6, il-8, TNFa, колониестимулирущие факторы.
В пролиферации Т-лимфоцитов принимает участие il-2, il-4, il-7, il-9, il-13, il-15, TNFa. Такое дублирование обеспечивает надежность функционирования цитокинового каскада. Под воздействием специфических антигенов происходит дифференцировка Т-хелперов на две субпопуляции: Th1 и Тh2, различающихся по антигенам главного комплекса гистосовместимости и продуцируемым цитокинам. Th1 секретируют преимущественно провоспалительные цитокины, аTh2 -регуляторные, вызывающие в основном гуморальные реакции гемопоэза, ангиогенез.
Генерализованный характер высвобождения цитокинов проявляется рядом системных эффектов. Известно, что летальность при септическом шоке определяется не столько воздействием эндотоксина, сколько возникающим в ответ на его введение повышенным уровнем провоспалительных цитокинов.
Важнейшими антагонистами провоспалительных цитокинов являются регуляторные цитокины — il-4, il-10.
Таким образом, система цитокинов при всем многообразии представляет собой единую и целостную сеть, нарушения в которой могут вести к срыву саморегуляции, изменению направленности иммунного ответа, что приобретает особую значимость на ранних этапах развития эмбриона.
Поэтому чрезвычайно важно, чтобы все параметры цитокинов были в пределах нормы накануне наступления беременности. Нормальное течение беременности во многом определяется соотношением иммуномодулирующих и иммуносупрессивных эффектов в эндометрии, трофобласте, а в последующем и в плаценте, в регуляции которых принимает непосредственное участие компоненты цитокиновой системы.
Аутоиммунитет — зеркальное отражение толерантности, указывает на потерю организмом толерантности, невосприимчивости к собственным антигенам. В норме иммунная система сдерживают аутореактивность лимфоцитов с помощью регулярных механизмов. Нарушение их может привести к аутоиммуной патологии. В литературе описывается много вариантов развития аутоиммунитета. Предполагают, что внутриклеточная вирусная инфекция меняет антигенную природу «своей» клетки, в результате чего могут появиться антитела против «своей» клетки. Возможно, что микроорганизмы имеют общие антигены с организмом человека, в этом случае имеет место недостаточная элиминация всех аутореактивных В-лимфоцитов и появление аутоантител. Предполагают наличие генетических влияний на уровне В-лимфоцитов, субпопуляций Т-клеток, макрофагов, тканей-мишеней и гормонов.
Аутоиммунные заболевания чаще встречаются и более тяжело протекают у женщин. В последние годы внимание ученых мира приковано к аутоиммунным процессам в организме человека и в частности в акушерской практике. Было чрезвычайно много выполнено исследований для понимания значимости этих нарушений, в том числе и в акушерской патологии.
Наиболее значимым аутоиммунным нарушением для акушерской практики является антифосфолипидный синдром. Частота встречаемости антифосфолипидного синдрома среди пациенток с привычным невынашиванием составляет от 27-42%.
Определение волчаночного антикоагулянта проводится гемостазиологическими методами. В акушерской практике большое значение имеет волчаночный антикоагулянт. Полагают, что выявление в крови волчаночного антикоагулянта является качественным проявлением действия определенных уровней аутоантител к фосфолипидам (кардиолипин, фосфатидилэтанол, фосфатидилхолин, фосфатидилсерин, фосфатидилиназитол, фосфотидиловая кислота) на состояние гемостаза.
Группой риска по наличию аутоантител к фосфолипидам является следующая категория больных, в анамнезе которых имеется: привычное невынашивание беременности неясного генеза, внутриутробная гибель плода во II и III триместрах беременности, артериальные и венозные тромбозы, цереброваскулярные заболевания, тромбоцитопения неясного генеза, ложноположительные реакции на сифилис, ранний токсикоз второй половины беременности, задержка внутриутробного развития плода, аутоиммунные заболевания.
Антикардиолипиновые антитела, антитела к другим фосфолипидам, фосфоэтаналамину, фосфотидилхолину, фосфатидилсерину и фосфотидиловой кислоте определяются иммуноферментным анализом Elisa.
Как полагают исследователи один и тот же пул клеток иммунной системы продуцирует не только антитела к фосфолипидам, но и другие антитела: анти-ДНК антитела, антинуклеарные антитела, антитиреоидные, антиспермальные. Полагают, что на долю этих антител приходится до 22% привычного невынашивания иммунного генеза и около 50% бесплодия неясного генеза и неудач ЭКО.
Эти антитела могут быть направлены как против двойной молекулы ДНК, так и одинарной, а также против полинуклеатидов и гистонов. Наиболее часто они выявляются при аутоиммунных заболеваниях, но могут быть антитела без проявления аутоиммунного заболевания. Другие исследователи не разделяют эту точку зрения. По их данным исследований, эти аутоантитела неспецифичны, часто транзиторны, нет научных данных, объясняющих механизм их действия при привычном невынашивании. По данным исследований, эти антитела необходимо иметь в виду, так как они могут быть маркерами аутоиммунного неблагополучия, и хотя научного объяснения механизма их действия пока нет, беременность всегда протекает с осложнениями в виде плацентарной недостаточности, задержки внутриутробного развития.
В последние годы появились работы о значении антител к гормонам. Пул клеток продуцирующих антитела CD 19+5+. Активация этих клеток ведет к появлению аутоантител к гормонам, имеющим важнейшее значение для нормального течения беременности: эстрадиолу, прогестерону, хорионическому гонадотропину, тиреоидным гормонам, гормону роста.
При избытке CD19+5+ в связи с наличием аутоантител к гормонам наблюдается целый ряд клинических проявлений этого синдрома: недостаточность лютеиновой фазы, неадекватная реакция на стимуляцию овуляции, синдром «резистентных яичников», преждевременное «старение» яичников и преждевременная менопауза. При появлении аутоантител действие активированных CD19+5+ ведет к нарушениям ранней имплантации, к некрозам и воспалению в децидуа, к нарушению образования фибриноида, к избыточному отложению фибрина. При ЭКО у этих больных отмечается медленное деление и фрагментация эмбрионов, медленный прирост уровня хорионического гонадотропина при беременности, повреждение желточного мешка, субхориальные гематомы.
В нашей клинике мы можем определить только антитела к хорионическому гонадотропину и придаем этому аспекту большое значение в привычном невынашивании беременности.
Этот же пул клеток продуцирует аутоантитела к нейротрансмиттерам, включая серотонин, эндорфины и энкефалины. При наличии этих антител отмечается резистентность яичников к стимуляции, снижение кровообращения в матке, наблюдается истончение эндометрия, часто возникают депрессии, фибромиалгии, нарушения сна, в том числе ночная потливость, панические атаки и т.д.
К сожалению, многие методы выявления аутоантител не стандартизированы, требуют уточнения механизма действия. Практическим врачам надо знать о существовании этого направления исследования при выкидышах неясного генеза, направлять в специализированные лаборатории и отделения, а не решать эту проблему назначением но-шпы и прогестерона.

источник

В первые недели беременности происходит перестройка иммунной системы матери и формирования механизмов адаптации к присутствию развивающего в утробе организма.
Несмотря на то, что эмбрион развивается из яйцеклетки- клетки репродуктивной системы женщины, после оплодотворения генетический код будущего организма состоит из комбинации ДНК матери и отца и является уникальным. Клетки будущего организма продуцируют собственные белки и иммунные агенты, которые могут взаимодействовать с иммунной системой матери как непосредственно на ранних этапах, так и через гемато-плацентарный барьер после формирования детского места (плаценты).
Во время беременности и раннего послеродового периода изменяется как количественный, так и качественный состав иммунокомпетентных клеток периферической крови. С начала беременности и в течение всего срока беременности абсолютное количество Т-лимфоцитов и их основных разновидностей (CD4 и CD8) уменьшается. В послеродовом периоде количество T-лимфоцитов в крови повышается. Эти изменения отражают общую картину изменений иммунной системы в организме матери во время беременности.
Однако говорить о беременности как об иммунодефицитном состоянии вряд ли возможно. Поскольку, несмотря на состояние подавления активности клеток иммунного ответа женщины к клеткам плода, у беременной сохранен динамический антиген-специфический иммунный ответ T-лимфоцитов, которые отвечают за клеточное звено иммунного ответа. Большое число пролиферирующих T-лимфоцитов в крови беременной женщины четко определяется уже на 9-10 неделе после зачатия. Эти изменения достигают максимума во втором триместре беременности. После 30 недель беременности почти все пролиферировавшие клетки исчезают. К моменту родов уровень Т-лимфоцитов возвращается к нормальным значениям.
Доказано, что Т-лимфоциты матери распознают антигены плода. Этот антиген-специфический иммунный ответ на отцовские антигены приводит к увеличению количества и накоплению определенных видов T-лимфоцитов. Во время беременности происходит «обучение» T-лимфоцитов матери к унаследованным от отца антигенам тканевой совместимости.
Во время беременности в матке содержится большое количество и других клеток, отвечающих за неспецифический иммунный ответ — макрофагов, располагающихся в эндометрии и миометрии. Их количество регулируется гормонами яичников. Макрофаги содержат рецепторы к эстрогенам- женским половым гормонам, также матка выделяет специальные вещества, которые способствуют миграции макрофагов в область детского места.
Хорошо известна продукция антител против антигенов отца во время беременности. При нормальном развитии беременности отцовские антигены, циркулирующие в крови иммунокомплексы с отцовскими антигенами и свободные антитела к отцовским антигенам определяются с ранних сроков беременности. Иммунный ответ матери направлен против некоторых, но не против всех несовпадающих тканевых антигенов плода. Роль антител, направленных против отцовских антигенов, в иммунном гомеостазе при беременности до сих пор до конца не ясна. Есть данные, что женщины, совместимые с мужем по тканевым антигенам, не вырабатывают достаточного количества антител к антигенам плода и страдают привычным невынашиванием беременности. Иммунизация таких женщин отцовскими Т и B-лимфоцитами с последующим появлением антител к тканевым антигенам мужа приводит к восстановлению фертильности и рождению доношенных детей.
В настоящее время предполагаются следующие механизмы защитного действия антител к антигенам плаценты при беременности:
1. Подавление клеточно-зависимого иммунитета.
2. Подавление цитотоксичности клеток-киллеров.
3. Поддержка роста и дифференцировки плаценты за счет выработки специфических гормонов.
4. Улучшение симптомов аутоиммунных заболеваний.
5. Развитие противовирусной защиты плода, в частности против ВИЧ-инфекции.
Было обнаружено несколько белковых молекул, подавляющих выработку клетками-киллерами фактора некроза опухоли (ТНФ), который может повреждать плаценту. Спермин, фактор, в больших количествах присутствующий в плацентарной жидкости, противодействует иммунному ответу матери, подавляя продукцию ТНФ и других провоспалительных белков. Было показано, что для подавления выработки ТНФ спермином необходим еще один ко-фактор, гликопротеин плазмы плода фетуин. Уровни обоих белков в околоплодных водах и в крови плода достаточно велики, а соотношение их оптимально для эффективного подавления секреции ТНФ. Фактор ранней беременности (EPF) тоже, по всей видимости, является иммуномодулирующим протеином. EPF является низкомолекулярным белком, который вырабатывается живыми эмбрионами до имплантации. Он появляется в сыворотке крови беременных женщин через 48 часов после оплодотворения, обладает иммуносупрессивным действием и не обнаруживается в случае гибели оплодотворенного яйца. Это чувствительный маркер, отражающий жизнеспособность зародыша.
Подводя итог анализу развития иммунологических взаимоотношений между матерью и плодом, можно сказать следующее. Трофобласт— эмбриональный листок из которого впоследствии развивается плацента- пролиферирует, внедряется в ткани матки и поступает в кровоток матери. В результате этого образуются антиотцовские антитела, которые фиксируются на плаценте. Они обладают иммунотропным действием, блокируя эфферентное звено иммунного ответа на местном уровне. Плацента становится иммунологически привилегированной тканью. Трофобласт выступает также в роли иммуносорбента, связывая антитела, являющиеся иммунорегуляторами, и устанавливая иммунный камуфляж, блокирующий эфферентное звено иммунного ответа. У женщин с привычным невынашиванием беременности, с бесплодием неясного генеза, с неоднократными неудачными попытками ЭКО, иммунопротективное действие трофобласта не включается полностью, что приводит к инициации клеточного и гуморального иммунного ответа против беременности.
К 10 неделям беременности плод становится не просто иммунологическим паразитом, но иммунологическим партнером матери. Это взаимодействие приводит к развитию иммунологического воздействия в организме матери, который оставляет след на всю жизнь. После установки иммунологического симбиоза между матерью и плодом, система становится исключительно устойчивой к неблагоприятным иммунологическим воздействиям. Гормональные и другие события, запрограммированные на конец беременности, приводят к разрыву иммунологического симбиоза. После родов матка восстанавливается и становится готова к следующей успешной беременности от данного отца. Смена супруга может приводить к новым, в том числе и неблагоприятным типам иммунного ответа во время беременности.
Супрессия специфического звена иммунного ответа матери при беременности не просто сопровождается, но и компенсируется активацией системы неспецифического иммунитета. Это означает, что при беременности возникает новое уникальное равновесное состояние между специфическим и неспецифическим иммунитетом матери, при котором центральной клеткой иммунной адаптации матери становится не лимфоцит, но моноцит.
Активация системы естественного иммунитета во время беременности обеспечивает эффективную защиту организма от большинства бактериальных инфекций. Однако этого часто бывает недостаточно для элиминации внутриклеточных возбудителей, таких как листерии или вирусы. Поэтому вирусные инфекции во время беременности могут протекать тяжелее, чем вне беременности. Гиперактивация системы естественного иммунитета во время беременности может служить одним из факторов развития таких нарушений, как невынашивание беременности и нефропатия беременных (системная эндотелиальная дисфункция).

Известно, что развитие аутоиммунного тиреоидита может быть связано с аутоиммунным ответом на тиреоглобулин, транспортным белком, переправляющим гормоны щитовидной железы в кровь. На следующем этапе заболевания могут поражаться митохондрии клеток щитовидной железы, что сопровождается появлением антител к тиреоидной пероксидазе, а иногда и к микросомальному тиреоидному антигену. Далее следует включение в аутоиммунный процесс улеток специфицеского иммунного ответа. Считается, что именно повышение уровня этих клеток и является решающим фактором запуска реакций отторжения беременности при аутоиммунных процессах щитовидной железы.
Из гинекологических заболеваний к развитию иммунологических нарушений часто приводят хронические воспалительные заболевания, генитальные инфекции и эндометриоз. Часто бывает трудно выделить первичный фактор нарушений: являются ли гинекологические заболевания следствием иммунодефицитного состояния, или наоборот.
Также важным этапом являеься исследование тканевых антигенов супругов на совместимость, что также нередо является прининой первичного невынашивания беременности.
Методы лечебных воздействий при иммунологических нарушениях репродуктивной функции зависят от характера нарушений, степени нарушений и общего состояния женщины.
Наиболее эффективно проведение лечения в три этапа:
1.Общая иммунокоррекция и лечение сопутствующих заболеваний.
2.Подготовка к беременности.
3.Лечение во время беременности.
Общая иммунокоррекция и лечение сопутствующих заболеваний направлено на устранение иммунодефицитного состояния, выявленного при обследовании пациентки, лечение воспалительных заболеваний половых органов и генитальных инфекций, устранение дисбактериоза кишечника и влагалища, проведение общеукрепляющего лечения и психологической реабилитации. Наиболее успешным лечение невынашивания беременности бывает тогда, когда иммунологическая подготовка к беременности начинается как минимум за месяц до прекращения предохранения.
При наличии антифосфолипидного синдрома лечение обычно начинают с низких доз нестероидных противоспалительных препаратов, начатое за месяц до отмены контрацепции. В дальнейшем к этому лечению может присоединяться назначение препаратов гепаринового ряда (с 6-го дня следующего после начала предыдущего этапа терапии) и внутривенного введения иммуноглобулинов. Дозы и выбор препаратов должны быть строго индивидуальны. Чем больше выкидышей было в анамнезе, тем дозировка препаратов будет больше, и тем больше будет количество компонентов лечения.
При наличии анти-ДНК и антитиреоидных антител ведущая роль в подготовке к беременности принажлежит внутривенному капельному введению иммуноглобулинов. Следует учитывать тот факт, что период полужизни иммуноглобулинов составляет около 25 дней, поэтому инфузии проводятся с раз в месяц (как правило, от 1 до 3 капельниц в месяц). Дозировка препаратов подбирается индивидуально. Наиболее эффективным бывает насыщение организма иммуноглобулинами на начальном этапе, и поддерживающая терапия (раз в месяц) в дальнейшем.
При иммунных формах невынашивания, связанных с иммнологической несовместимостью тканевых антигенов партнеров и при повышении активности B-клеток имеет иммунизация женщины лимфоцитами мужа. При значительной степени совпадения генотипа супругов по тканевым антигенам может быть рекомендовано проведение иммунизации пациентки донорскими лимфоцитами. Через 3-4 недели после иммунизации лимфоцитами желательно исследование крови жены на анти-тканевые антитела. В некоторых случаях, особенно при значительном повышении уровня B-клеток, иммунизация лимфоцитами может проводиться каждые 5-7 недель вплоть до 10 недели беременности.
После наступления беременности продолжается поддерживающая терапия. Женщины, начавшие иммуннотерапию уже после наступления беременности имеют риск выкидыша в 2-3 раза больший по сравнению с теми женщинами, подготовка к беременности которых была начата своевременно. Дозы и препараты после наступления беременности подбираются индивидуально. Независимо от исходных нарушений, после наступления беременности большое значение имеет периодическое проведение исследования количественны показателей перефирической крови и анализа крови на аутоантитела с проведением адекватной коррекции в случае обнаружения отклонений.
источник
Иммунологические исследования — диагностические методы, базирующиеся на специфическом взаимодействии антигенов и антител. Широко применяются для лабораторных анализов инфекционных и паразитарных заболеваний, а также достоверного определения групп крови, нарушений гормонального фона, тканевых и опухолевых антигенов, распознавания аллергии и аутоиммунных процессов, видовой принадлежности белка, а также беременности.
 | 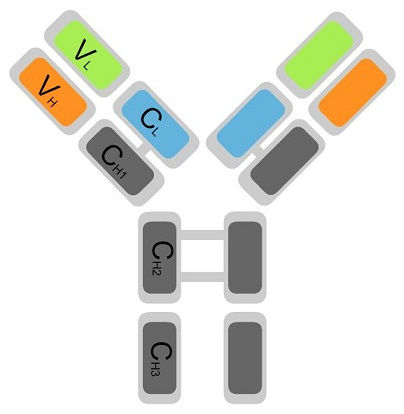 |
| Забор крови для иммунологического исследования | Строение иммуноглобулина |
- врожденные или приобретенные в ходе жизни иммунодефицитные состояния;
- аллергические заболевания, не реагирующие на эффективную терапию;
- инфекционные болезни хронического и вялотекущего типа;
- аутоиммунные и онкологические болезни;
- до и после операции по пересадке органов;
- подготовка к серьезным хирургическим вмешательствам;
- оценка эффективности разработанного лечения и анализа побочных явлений при назначении препаратов, влияющих на иммунитет.
Иммуноглобулин А (IgA) — это антитела, являющиеся защитным фактором слизистых оболочек человеческого организма. Входят в состав фракции б-глобулинов, составляют около 15% от общего количества иммуноглобулинов сыворотки крови. Содержатся в молоке, слюне, слезной жидкости, секретах слизистых оболочек.
- хронические заболевания печени;
- системная красная волчанка;
- ревматоидный артрит;
- миеломная болезнь;
- гломерулонефрит;
- алкогольное поражение внутренних органов.
- физиологическое снижение у детей младше 6 месяцев;
- цирроз печени;
- лучевая болезнь,
- отравления (толуол, бензин, ксилол);
- применение цитостатиков и иммунодепрессантов.
Иммуноглобулин Е (IgE) принимает участие в аллергических реакциях и противопаразитарном иммунитете.
- паразитарные инвазии (аскариды, нематоды, токсоплазма, шистосома, эхинококки, трихинелла, амебы);
- аллергический ринит;
- крапивница;
- сенная лихорадка;
- аллергические заболевания;
- бронхиальная астма.
Иммуноглобулин G (IgG) обеспечивает пассивный иммунитет.
- ревматизм;
- системная красная волчанка;
- ревматоидный артрит;
- миеломная болезнь;
- ВИЧ;
- инфекционный мононуклеоз;
- острые и хронические инфекционные заболевания.
- физиологическое снижение у детей младше 6 месяцев,
- лучевая болезнь,
- лечение цитостатиками и иммунодепрессантами,
- отравления (толуол, бензин, ксилол),
- цирроз печени.
Иммуноглобулин М (IgM) входит в состав фракции у-глобулинов. Первым появляется после введения антигена. К IgM относятся противоинфекционные антитела, антитела групп крови, ревматоидный фактор.
- острые грибковые, паразитарные, вирусные и бактериальные инфекции,
- гепатит и цирроз печени,
- ревматоидный артрит,
- системная красная волчанка,
- кандидоз,
- системные васкулиты.
- физиологическое снижение у детей младше 6 месяцев,
- спленэктомия,
- лучевая болезнь,
- лечение иммунодепрссантами и цитостатиками,
- отравления (толуол, ксилол).
Аллоиммунные антитела — это антитела к клинически наиболее важным эритроцитарным антигенам, в первую очередь, к резус-фактору.
Показания к назначению анализа:
- беременность (профилактика резус-конфликта),
- наблюдение за беременными с отрицательным резус-фактором,
- невынашивание беременности,
- гемолитическая болезнь новорожденных,
- подготовка к переливанию крови.
Антинуклеарный фактор при определении совместно с антителами к ДНК является диагностические критерием системной красной волчанки.
- системная красная волчанка,
- хронический гепатит,
- ревматоидный артрит,
- волчаночный нефрит,
- системные васкулиты.
Антистрептолизин-О — маркер наличия стрептококковой инфекции в организме, является лабораторным критерием ревматизма.
Показания к назначению анализа:
- острый гломерулонефрит,
- ревматизм (уровень повышен у 85%),
- рожистое воспаление,
- скарлатина,
- стрептококковые инфекции (ангина, хронический тонзиллит, пиодермия, остеомиелит).
Антиспермальные антитела (ИФА) — дополнительный тест в диагностике иммунологических причин бесплодия у мужчин и женщин. Антиспермальные антитела обнаруживаются в крови, в слизи шейки матки, семенной плазме, на поверхности сперматозоидов. У мужчин лучше определять антиспермальные антитела в сперме. Сомнительные (близкие к пороговым) значения: 55-60 Ед./мл. В подобных случаях исследование целесообразно повторить через 2 недели.
Показания к назначению анализа:
- необъяснимое бесплодие супружеской пары,
- изменения спермограммы.
Повышение значений: вероятный фактор бесплодия.
MAR-тест (Mixed agglutination reaction) — количественное определение наличия/отсутствия антиспермальных антител класса А с использованием латексных частиц на поверхности сперматозоидов. Тест определяет отношение (процент) нормальных неподвижных сперматозоидов, но покрытых антиспермальными антителами, к общему количеству сперматозоидов.
Показания к назначению анализа:
- бесплодный брак,
- предполагаемое иммунологические бесплодие у мужчин.
- высокая вероятность данной причины мужского бесплодия.
Антитела к тиреоглобулину (АТ-ТГ) — антитела к предшественнику тиреоидных гормонов.
Показания к назначению анализа:
- новорожденные, высокий уровень антител к тиреоглобулину у матери;
- взрослые: хронический тиреоидит Хашимото, диагностика гипотиреоза, зоб, диффузный токсический зоб (болезнь Грейвса).
- хронический тиреоидит Хашимото,
- идиоматический гипотиреоз,
- аутоиммунный тиреоидит,
- диффузный токсический зоб (болезнь Грейвса),
- синдром Дауна (слабо положительный результат),
- синдром Тернера.
Антитела к тиреоидной пероксидазе (AT-ТПО) — антитела к ферменту клеток щитовидной железы, участвующему в синтезе тиреоидных гормонов, их присутствие — показатель агрессии иммунной системы по отношению к собственному организму. Это наиболее чувствительный тест для обнаружения аутоиммунного заболевания щитовидной железы.
Показания к назначению анализа:
- новорожденные: повышенные показатели гормонов щитовидной железы, высокий уровень АТ-Т ПО или болезнь Грейвса у матери;
- взрослые: диагностика нарушений уровня гормонов щитовидной железы, зоб, болезнь Грейвса (диффузный токсический зоб), хронический тиреоидит Хашимото, офтальмопатия: увеличение окологлазных тканей (подозрение на эутиреоидную болезнь Грейвса — при нормальных показателях уровня гормонов щитовидной железы).
- болезнь Грейвса (диффузный токсический зоб),
- узловой токсический зоб,
- подострый тиреоидин (де Кревена),
- послеродовая дисфункция щитовидной железы,
- хронический тиреоидит Хашимото,
- аутоиммунный тиреоидит,
- нетиреоидные аутоиммунные заболевания.
HLA-типирование 2 класса (human leucocyte antigens) — антигены тканевой совместимости (cиноним: MHC — major histocompatibility complex — главный комплекс гистосовместимости). HLA-фенотип определяется методом полимеразной цепной реакции (ПЦР).
Это исследование не является рутинным (массовым) и выполняется для диагностики только в сложных случаях:
- оценка риска развития ряда заболеваний с известной генетической предрасположенностью,
- выяснение причин бесплодия,
- выяснение причин невынашивания беременности (привычных выкидышей),
- выяснение причин иммунологической несовместимости,
- трансплантация органов и тканей,
- оценка риска сахарного диабета 1 типа при семейной отягощенности.
НLА антигены 1 класса представлены на поверхности практически всех клеток организма, в то время как белки тканевой совместимости 2 класса располагаются на клетках иммунной системы, макрофагах, эпителиальных клетках.
Благоприятный прогноз пересадки органа выше при наибольшем сходстве донора и реципиента по антигенам тканевой совместимости.
Сходство супругов по антигенам тканевой совместимости приводит к «похожести» что становится причиной недостаточной антигенной стимуляции иммунной системы женщины, и необходимые для сохранения беременности реакции не запускаются. Беременность воспринимается как чужеродные клетки и происходит самопроизвольное прерывание беременности. Эта «чужеродность» является нормальным явлением, запускающим иммунологические реакции, направленные на сохранение беременности. Формируется группа иммунных клеток, вырабатывающих специальные «блокирующие» антитела. При нормальном развитии беременности «блокирующие» антитела к отцовским HLA-антигенам появляются с самых ранних сроков беременности, причем самыми ранними являются антитела к антигенам 2 класса тканевой совместимости.
| Показатель | Норма |
| Иммуноглобулин А (IgA) | 0,9—4,5 г/л |
| Иммуноглобулин Е (IgE) | 30—240 мкг/л |
| Иммуноглобулин G (IgG) | 7—17 г/л |
| Иммуноглобулин М (IgM) | 0,5—3,5 г/л |
| Аллоиммунные антитела | отрицательно |
| Антинуклеарный фактор | отрицательно |
| Антистрептолизин-О | 0—7 лет — менее 100 Ед/мл; 7—14 лет — 150—250 Ед/мл; 14—90 лет — менее 200 Ед/мл |
| Антиспермальные антитела (ИФА) | 0—60 Ед/мл |
| MAR-тест | менее 50% |
| Антитела к тиреоглобулину (АТ-ТГ) | титр Online диагноз |
Размещение рекламы, сотрудничество: info@online-diagnos.ru
Сайт не несет ответственность за содержание и достоверность размещенного пользователями на сайте контента, отзывы посетителей сайта. Материалы сайта носят исключительно информационно-ознакомительный характер. Содержание сайта не является заменой профессиональной консультации врача-специалиста, диагностики и/или лечения. Самолечение может быть опасно для здоровья!
источник
Обследование при иммунологических проблемах репродукции: иммунном бесплодии и невынашивании беременности
а. Два выкидыша или две неудачные попытки ЭКО или ГИФТ в возрасте старше 35 лет или три выкидыша/три неудачи при ЭКО или ГИФТ в возрасте до 35 лет.
б. недостаточный ответ яичников на стимуляцию овуляции (менее 6 яйцеклеток).
г. беплодие неясного генеза
д. диагностированные иммунологические проблемы (антиядерные антитела, ревматоидный артрит и/или системная красная волчанка)
е. осложненный акушерский анамнез – задержка развития плода во время предыдущих беременностей.
ж. Один живой ребенок и повторные выкидыши при попытке вынашивания следующих беременностей
Этот анализ позволяет определить, насколько совпадают последовательности ДНК в супружеской паре. При нормальной беременности отцовские гены эмбриона, чужие для материнского организма, заставляют его вырабатывать защитную реакцию в отношении эмбриона. Если ДНК отца очень сильно совпадает с материнской, эмбрион может оказаться генетически почти одинаковым с материнским, и тогда материнский организм не распознает его как ребенка, и произойдет реакция отторжения.
Каждый человек получает два гена DQ от своих родителей. Эти гены обозначаются следующим образом: 1,1; 1,2; 1,3; 1,4; 2, 3, 4. Многие ученые считают, что значение имеют только гены 1, поэтому они их подразделили (1,1; 1,2 и т.д). В настоящее время находят все новые и новые показатели: 4,0; 4,1; 4,2 и 4,3.
Каждый антиген DQ имеет альфа– и бета– цепи. Т.о, имеются два разных анализа – альфа– и бета-тест. Большинство пациентов проходят обследования только по альфа-тесту. Если у мужчины и женщины обнаруживаются DQальфа 4 или у мужчины – DQ альфа 2, выполняется DQ бета тестирование.
По новой терминологии мужчины с DQ альфа 2 считаются с DQ альфа 201. В 2% случаев мужчина, имеющий DQ альфа 201, имеет и DQ бета 201. При оплодотворении яйцеклетки сперматозоидом с таким генотипом происходит гибель зиготы в 50%. Если только один DQ антиген (альфа или бета) является 201, вероятность образования такой зиготы в два раза меньше. Ни у одного мужчины, даже если имеется два DQ альфа 2-гена, не могут все сперматозоиды нести DQ бета 201 ген.
Когда гены DQ альфа 201 и бета 201 к эмбриону попадают от матери, эмбрион развивается нормально. Однако если эти гены (оба) приходят от отца, зигота гибнет. Поэтому на Земле не существует человека, имеющего оба DQ альфа 201 и бета 201 гена. Путем устранения этой проблемы является повышение числа созревающих яйцеклеток в каждом цикле, чтобы уменьшить вероятность развития беременности из зиготы, оплодотворенной DQ бета 201-сперматозидом.
У 89% людей с антителами к фосфолипидам либо имеется DQ альфа 4, либо близко совпадают значения DQ альфа у партнеров. Совпадение матери и ребенка по DQ альфа наблюдается при невынашивании беременности (наступившей или как неудачи ЭКО). При благополучном завершении беременности чаще наблюдается несоответствие по DQ между матерью и ребенком. Если у обоих родителей имеется DQ 4, у ребенка получается генотип DQ 4, 4. Некоторые из этих беременностей не ухудшают вероятность вынашивания второго ребенка, если только HLA G-молекулы у супругов не очень близки. Первый ребенок рождается после нормально протекавшей беременности, и единственная его проблема может заключаться в том, что он сам может быть родителем DQ 4, 4-ребенка и иметь проблемы с вынашиванием второго ребенка. К сожалению, первая DQ 4, 4 – беременность активирует киллерные клетки материнского организма и снижает уровень блокирующих антител. В результате вынашивание второй и последующих беременностей становится невозможным без применения лимфоцитоиммунотерапии для повышения уровня защитных антител и внутивенного введения гамма-глобулина для снижения уровня киллерных клеток.
При совпадении показателей DQ во время беременности назначают гепарин в качестве превентивной меры, даже если тест на антифосфолипидные антитела был отрицательным до беременности. Было показано, что при совпадении генов DQ у родителей, во время беременности может возникнуть резкий всплеск уровня антифосфолипидных антител. Если после 10 недель беременности уровень антител так и остается низким, гепаринотерапию отменяют.
С помощью этого анализа изучают выраженность иммунологической цепной реакции, вызванной совпадением DQ-антигенов. Низкие результаты этого анализа говорят доктору о необходимости назначить иммуноцитотерапию лимфоцитами мужа. Некоторые доктора назначают внутривенное введение гамма-глобулина. Другие предлагают просто подсаживать большее число эмбрионов, чтобы снизить вероятность сохранения именно того эмбриона, у которого произойдет полное совпадение DQ-антигенов. Обычно используют лимфоциты мужа. Однако если антигены DQ альфа у супругов очень близки, то используют лимфоциты донора. Эта терапия дает положителный результат, если уровень антител у женщины к Т– и В– лимфоцитам ее мужа превышает 30%, и положителен тест микроцитотоксичности.
Этот анализ проводят для определения уровня есественных киллеров. В большинстве случаев наличие естественных киллерных клеток – хороший признак, поскольку они защищают организм от раковых опухолей. Однако бывают ситуации, когда их количество резко возрастает и убивает эмбрион или нарушает работу эндокринной системы, делая невозможным вынашивание беерменности. При высоких уровнях естественных киллеров назначается внутривенное введение иммуноглобулина. Наоборот, при низких уровнях естественных киллеров доктора назначают стероидные гормоны, в частности, преднизолон.
При этом анализе определяют следующие типы клеток:
CD56 (норма 3-12) (натуральные киллеры)
CD19/CD5 (норма 0-10). высокий уровень нарушает выработку необходимых для беременности гормонов.
CD19+/CD5+ Чем выше их уровень, тем больше продукция антител к таким гормонам, как эстрадиол, прогестерон, ХГЧ, а также к серотонину и эндорфинам. Нужно определить уровень антител к гормонам, чтобы доктор мог назначить нужное количество недостающих гормонов. Тест на определение антител к прогестерону Вы можете проделать самостоятельно. Возьмите ампулу с прогестероном, разбейте и нанесите каплю на внутреннюю поверхность предплечья. Сверху закройте пластырем. Первая реакция (покраснение, опухание и уртикарные высыпания вокруг), вызванная антителами, появляется через 15 мин. Затем кожа бледнеет и возвращается в нормальное сстояние, пока не наступит вторая реакция (обычно через 24 часа), вызванная рaботой CD19+/5+ клеток. Доложите о результатах своему доктору.
Эти антитела играют роль в патогенезе таких заболеваний, как ревматоидный артрит и системная красная волчанка а также могут приводить к невынашиванию беременности и бесплодию. Чаcто при этом обнаруживается титр антител 1:40 и выше при неоднородном паттерне. Такой паттерн нехарактерен для СКВ и РА.
Антитела к ДНК и гистонам
Если у женщины обнаруживаются антитела к гистонам, имеющие неоднородный паттерн, значит ее организм отторгает эмбрион.
При положительных результатах этого анализа нарушается свертываемость крови у матери, образуются микротромбы, которые нарушают снабжение кровью ребенка. Также эти антитела являются причиной плохого прикрепления эмбриона в матке. Лечение – аспирин и гепарин. Эти препараты назначают еще до беременности, в течение цикла зачатия. Это лечение хорошо известно и широко применяется врачами, иногда ои его назначают без проведения необходимых исследваний, и выкидыш все равно происходит, поскольку причиной невынашивания могли быть другие иммунологические нарушения, требующие проведения иммуноцитотерапии лимфоцитами мужа, внутривенного введения иммуноглобулина или назначения преднизолона.
Определение количества естественных киллеров.
С помощью этого анализа определяют цитотоксическую активность естественных киллеров in vitro. Естественные киллерные клетки помещаются в пробирку с клетками эмбриона. Высчитывается процент погибших эмбриональных клеток. Затем в пробирку добавляют гамма-глобулин, чтобы определить, остановит ли он активность киллеров, и какое его количество потребуется для прекращения цитотоксической реакции. Затем гамма-глобулин назначают женщинам перед зачатием, чтоб убедиться, что в их организме он работает с таким же эффектом, что и in vitro.
У 12% женщин с привычным невынашиванием беременности и у 25% с тремя и более неудачами ЭКО отмечен повышенный уровень натуральных киллеров высокая их цитотоксичность относительно клеток плаценты in vitro. Методика этого анализа проста. Натуральные киллеры выделяют из образца крови и инкубируют с возможными клетками-мишенями (клетки плаценты или эмбриона). Вычисляют исходное соотношение киллеров к клеткам-мишеням (50:1, 25:1, 12:1). Затем в культуру клеток добавляют иммуноглобулин в дозе 6,25 мг/мл (соответствует in vivo введению в дозе 25 г однократно) или 12,5 мг/мл (соответствует in vivo введению в дозе 25 г в течение трех дней последовательно). Затем высчитвается процент убитых клеток-мишеней в обоих образцах (с добавлением иммуноглобулина и без).
Естественные киллерные клетки образуются из стволовой клетки костного мозга. Существуют другие клетки в эндометрии, продуцирующие протеин ТJ6. Продукция этого белка стимулируется прогестероном; белок блокирует ДНК киллерных клеток, останавливая их развитие. Однако данный протеин не может остановить развитие стволовых клеток, из которых образуются новые киллеры. Данная проблема имеется у 2% пациентов с иммунологической патологией. Естественные киллерные клетки в эндометрии блокируются ТJ6 протеином при его присоединении к их мембране. У женщин с повторными неудачными попытками ЭКО и с привычным невынашиванием, получавших терапию иммуноцитотерапию, лечение аспирином, гепарином, преднизолоном и иммуноглобулином, находили в крови киллерные клетки с фиксированным на их поверхности ТJ6 протеином. Это означает, что они не были активированы в эндометрии, скорее всего потому что являлись пока стволовыми клетками плода, ждущими своей дифференцировки, и потому избегнувшими инактивации.
Если ТJ6 протеин не может контролировать уровень натуральных киллеров (или стволовых клеток на этапе дифференцировки), те начинают разрушать децидуа, которая является вторым слоем слизистой оболочки матки, питающим эндометрий. Поскольку обычное УЗИ способно измерить только толщину эндрметрия, с его помощью невозможно установить процесс уничтожения эндометрия естественными киллерами децидуальной оболочки. Применение допплеровского исследования позволяет обнаружить эту проблему при проверке зоны 3. Обратите внимание! Использование гормона Прототропина для стимуляции овуляции обостряет данное нарушение. Считается, что он стимулирует костный мозг, способствуя образованию большего числа естественных киллеров.
К ним относится определение волчаночного аникоагулянта, антител к гормонам, антител к щитовидной железе, иммунного и интерферонового статусов. Перед введением иммуноглобулина нужно проведение аллергического теста на иммуноглобулины.
Последним пунктом во всех алгоритмах является консультация лечащего врача и интерпретация им полученных результатов. Дальнейшее обследование и тактика лечения зависит от результатов базового алгоритма.
Интерпретация анализов (не может заменить поход к врачу и выработку дальнейшей тактики) – см. статью «Результаты анализов».
|