Количественное соотношение фракций общего белка крови, отражающее физиологические и патологические изменения состояния организма.
Общий белок сыворотки состоит из смеси белков с разной структурой и функциями. Разделение на фракции основано на разной подвижности белков в разделяющей среде под действием электрического поля.
Обычно методом электрофореза выделяют 5 — 6 стандартных фракций: 1 — альбумины и 4 — 5 фракций глобулинов (альфа1-, альфа2-, бета- и гамма-глобулины, иногда отдельно выделяют фракции бета-1 и бета-2 глобулинов). Глобулиновые фракции более разнородны.
Фракция альфа1-глобулина включает в себя острофазные белки: альфа1-антитрипсин (основной компонент этой фракции) — ингибитор многих протеолитических ферментов — трипсина, химотрипсина, плазмина и т. д., а также альфа1-кислый гликопротеин (орозомукоид). Он обладает широким спектром функций, в зоне воспаления способствует фибриллогенезу. К глобулинам относятся транспортные белки: тироксинсвязывающий глобулин, транкортин (функции — связывание и транспорт кортизола и тироксина соответственно), альфа1-липопротеин (функция — участие в транспорте липидов).
Фракция альфа2-глобулинов преимущественно включает острофазные белки — альфа2-макроглобулин, гаптоглобин, церулоплазмин. Альфа2-макроглобулин (основной компонент фракции) участвует в развитии инфекционных и воспалительных реакций. Гаптоглобин — это гликопротеин, который образует комплекс с гемоглобином, высвобождающимся из эритроцитов при внутрисосудистом гемолизе, утилизирующийся затем клетками ретикулоэндотелиальной системы. Церулоплазмин — специфически связывает ионы меди, а также является оксидазой аскорбиновой кислоты, адреналина, диоксифенилаланина (ДОФА), способен инактивировать свободные радикалы. Фракция бета-глобулинов содержит трансферрин (белок-переносчик железа), гемопексин (связывает гем, что предотвращает его выведение почками и потерю железа), компоненты комплемента (участвующие в реакциях иммунитета) и часть иммуноглобулинов. Фракция гамма-глобулинов состоит из иммуноглобулинов, (в порядке количественного убывания — IgG, IgA, IgM, IgE), функционально представляющих собой антитела, обеспечивающие гуморальную иммунную защиту организма от инфекций и чужеродных веществ.
При многих заболеваниях встречается нарушение соотношения фракций белков плазмы (диспротеинемия). Диспротеинемии наблюдаются чаще, чем изменение общего количества белка и при наблюдении в динамике могут характеризовать стадию заболевания, его длительность, эффективность проводимых лечебных мероприятий.
Парапротеинемия – появление на электрофореграмме дополнительной дискретной полосы, свидетельствующей о присутствии в большом количестве однородного (моноклонального) белка, обычно иммуноглобулинов или отдельных компонентов их молекул, синтезирующихся в В-лимфоцитах. Большие концентрации М-белка (больше 15 г/л) с большой вероятностью указывают на миелому.
Исследование белковых фракций при подозрении на миелому имеет особую диагностическую ценность. Лёгкие цепи иммуноглобулинов (белок Бенс-Джонса) свободно проходят через сывороточный фильтр и на электрофореграмме сыворотки могут не определяться. Малые М-белки иногда могут наблюдаться при хронических гепатитах, доброкачественно — у пациентов престарелого возраста. Имитировать малую парапротеинемию могут большие концентрации С-реактивного белка и некоторых других острофазных белков, присутствие в сыворотке фибриногена, иногда – лекарственные препараты на основе моноклональных антител в пиковой концентрации (используются в качестве противоопухолевых препаратов, иммунодепрессантов и др.).
Внимание! Данное исследование отдельно не выполняется, только в комплексе с тестами: №28 Общий белок (в крови) (Protein total) .
источник
Белковые фракции представляют собой отдельные виды белков крови: альбумин, альфа1-, альфа2-, бета- и гамма-глобулины. Их исследование используется в качестве дополнительного теста в диагностике многих заболеваний.
Важное диагностическое значение имеют количественные взаимоотношения между отдельными белками сыворотки крови. Для разделения всех белков сыворотки используется метод электрофореза, основанный на различной подвижности белков сыворотки в электрическом поле.
С помощью электрофореза белки подразделяются на следующие фракции: альбумины и глобулиновые фракции (альфа1-глобулины, альфа2-глобулины, бета-глобулины и гамма-глобулины):
1. Альфа1-глобулины: альфа1-антитрипсин, альфа1-кислый гликопротеин, альфа-1 липопротеин.
2. Альфа2-глобулины: альфа2-макроглобулин, гаптоглобин, аполипопротеины, церулоплазмин.
3. Бета-глобулины: трансферрин, С3 компонент системы комплемента, бета-липопротеины, гемопексин.
4. Гамма-глобулины: иммуноглобулины — IgA, IgM, IgG.
В результате развития острых или обострения хронических воспалительных заболеваний соотношение белковых фракций изменяется.
Уменьшение количества того или иного вида белка наблюдается при иммунодефицитах, которые свидетельствуют о серьезных процессах в организме (аутоиммунные заболевания, ВИЧ, онкология и т.д.). Избыток того или иного вида белка свидетельствует о моноклональной гаммапатии (производство аномальных типов иммуноглобулинов). К последствиям гаммапатии можно отнести множественную миелому (рак плазматических клеток), макроглобулинемию Вальденстрема (опухоль костного мозга) и т.д.
Исследование белковых фракций является более информативным в диагностическом отношении, чем определение только общего белка или альбумина. При многих заболеваниях часто изменяется процентное соотношение белковых фракций, хотя общее содержание белка в сыворотке крови остаётся в пределах нормы.
При некоторых заболеваниях в крови появляются белки, отличающиеся в физическом, химическом и иммунологическом отношении от обычных белков сыворотки крови. Их называют моноклональными иммуноглобулинами (парапротеины, М-протеины). При проведении электрофореза белков сыворотки крови о наличии парапротеинов свидетельствует появление на электрофореграмме дополнительной (у здоровых людей отсутствует) узкой и резко ограниченной фракции белков (её ещё называют М-градиент) в области гамма-глобулинов.
Обнаружение парапротеинов наиболее характерно для парапротеинемических гемобластозов (миеломная болезнь, макроглобулинемия Вальденстрема, болезнь тяжёлых цепей), реже встречается при хронических гепатитах, у некоторых пациентов престарелого возраста. Имитировать М-белок могут высокие концентрации С-реактивного белка и фибриногена.
Повышение альфа-1- и альфа-2-глобулинов может наблюдаться при острых и обострениях хронических воспалительных процессов, при диффузных заболеваниях соединительной ткани (системная красная волчанка, ревматизм, ревматоидный артрит и др.), злокачественных опухолях, некоторых болезнях почек, протекающих с нефротическим синдромом (гломерулонефрит, амилоидоз и др.).
Снижение уровня альфа-2-глобулинов может наблюдаться при хроническом панкреатите, сахарном диабете, реже при токсических гепатитах. Повышение содержания бета-глобулинов чаще всего встречается у людей с нарушением липидного (жирового) обмена, в том числе у пациентов с атеросклерозом, ишемической болезнью сердца, гипертонией.
Снижение бета-глобулинов встречается реже и обычно обусловлено общим дефицитом белков плазмы.
Повышение количества гамма-глобулинов, являющихся основными «поставщиками» антител, нередко наблюдается при хронических заболеваниях печени (хронический гепатит, цирроз), хронических инфекциях, некоторых аутоиммунных заболеваниях (ревматоидный артрит, хронический аутоиммунный гепатит и др.), миеломной болезни.
Снижение гамма-глобулинов в крови встречается в норме у детей в возрасте 3-4 месяцев (физиологическое снижение), а у взрослых всегда имеет патологический характер и обычно указывает на врожденные или приобретенные иммунодефицитные состояния, нередко наблюдается при системной красной волчанке.
1. Для большинства исследований кровь рекомендуется сдавать утром, в период с 8 до 11 часов, натощак (между последним приемом пищи и взятием крови должно пройти не менее 8-ми часов, воду можно пить в обычном режиме), накануне исследования легкий ужин с ограничением приема жирной пищи. Для тестов на инфекции и экстренных исследований допустимо сдавать кровь через 4-6 часов после последнего приема пищи.
2. ВНИМАНИЕ! Специальные правила подготовки для ряда тестов: строго натощак, после 12-14 часового голодания, следует сдавать кровь на гастрин-17, липидный профиль (холестерин общий, холестерин-ЛПВП, холестерин-ЛПНП, холестерин-ЛПОНП, триглицериды, липопротеин (а), аполипо-протен А1, аполипопротеин В); глюкозотолерантный тест выполняется утром натощак после 12-16 часов голодания.
3. Накануне исследования (в течение 24 часов) исключить алкоголь, интенсивные физические нагрузки, прием лекарственных препаратов (по согласованию с врачом).
4. За 1-2 часа до сдачи крови воздержаться от курения, не употреблять сок, чай, кофе, можно пить негазированную воду. Исключить физическое напряжение (бег, быстрый подъем по лестнице), эмоциональное возбуждение. За 15 минут до сдачи крови рекомендуется отдохнуть, успокоиться.
5. Не следует сдавать кровь для лабораторного исследования сразу после физиотерапевтических процедур, инструментального обследования, рентгенологического и ультразвукового исследований, массажа и других медицинских процедур.
6. При контроле лабораторных показателей в динамике рекомендуется проводить повторные исследования в одинаковых условиях – в одной лаборатории, сдавать кровь в одинаковое время суток и пр.
7. Кровь для исследований нужно сдавать до начала приема лекарственных препаратов или не ранее, чем через 10–14 дней после их отмены. Для оценки контроля эффективности лечения любыми препаратами нужно проводить исследование спустя 7–14 дней после последнего приема препарата.
источник
Код исследования: В69
Определение свободных легких цепей иммуноглобулинов (капа и лямбда) в сыворотке крови и в суточной моче (выявление белка Бенс-Джонса) – показатель в диагностике множественной миеломы (болезнь Рустицкого-Калера, миеломная болезнь). Основные показания к применению (c учетом клинической картины заболевания): боли в костях, патологические переломы, анемия, полинейропатия, неясные лихорадки, гиперкальциемия, протеинурия, изменения картины электрофореза белков.
Множественная миелома – это злокачественное заболевание плазматических клеток в результате их злокачественной пролиферации, происходящей главным образом в костном мозге, но иногда и в экстрамедуллярных очагах. Относится к гематоонкологическим заболеваниям. Поражаемые клетки – это плазматические клетки, являющиеся разновидностью лейкоцитов, которые вырабатывают в нашем организме иммуноглобулины (антитела). Плазматические клетки — разновидность клеток соединительной и кроветворной тканей; образуются у позвоночных животных и человека из стволовых кроветворных клеток костного мозга, являются конечным этапом развития B-лимфоцита. Основная функция – выработка антител. Каждый плазмоцит секретирует иммуноглобулины только одного класса.
Термин «миелома» впервые был предложен в 1873 году Рустицким для обозначения опухоли, развивающейся множественно в костном мозге. В 1900 г. Райт обратил внимание на связь этой болезни с поражением плазматических клеток.
Миелому обычно называют «множественной миеломой», поскольку в костях обнаруживают сразу несколько очагов или участков образования опухолей. Единичная опухоль из миеломных клеток называется изолированной плазмацитомой.
Опухолевая ткань разрастается преимущественно в плоских костях — череп, рёбра, таз и в позвоночнике, приводя к остеолизису и остеопорозу. Множественная миелома может проявляться патологическими переломами, болями в костях, анемией, снижением гемоглобина, тромбозами, кровотечениями. При разрушении костей в крови увеличивается содержания кальция , который в виде конкрементов откладывается в почках, лёгких. Миеломная нефропатия в основном обусловлена поступлением через почечный фильтр парапротеинов. Характерным для миеломной болезни является частота бактериальных инфекций вследствие уменьшения количества нормальных иммуноглобулинов и нарушения образования антител.
Иммуноглобулины разных классов (G, A, M, D, E) характеризуются общим строением. Легкие L-цепи одинаковы у всех иммуноглобулинов, тогда как тяжелые Н-цепи гетерогенны. Молекула иммуноглобулина содержит две легкие и две тяжелые цепи. Легкие цепи существуют в двух формах: каппа-цепи и лямбда-цепи.
От типа тяжелых цепей зависит принадлежность молекулы иммуноглобулина к тому или иному классу иммуноглобулинов.
Вырабатываемые пораженными клетками антитела различных видов в избыточных количествах, легкие и тяжелые цепи иммуноглобулинов принято называть парапротеинами. Их можно обнаружить в крови или в моче методом электроиммунофореза. Легкие цепи способны проходить через почечный фильтр и поэтому их находят в моче. Лёгкие цепи иммуноглобулинов, обнаруживаемые в моче или в крови называются — белок Бенс-Джонса. Белок Бенс-Джонса, примерно в 60% случаев, выявляют чаще в моче больных множественной миеломой. Чаще легкие цепи обнаруживаются в моче за счет концентрирующего эффекта и реже, в крови. Считается, что при доброкачественных парапротеинемиях белок Бенс-Джонса не выявляется, поэтому его определение используют как скрининговое исследование при подозрении на миелому.
Следует учитывать, термин — «белок Бенс-Джонса» не всегда можно отнести к наличию легких цепей. Поскольку, даже при наличии в моче легких цепей только в 10% случаев их поведение соответствует тому эффекту, который показал автор (преципитация и растворение при нагревании и охлаждении мочи). Для определения белка Бенс-Джонса применяют нагревание мочи. При 56° С белки преципитируют, а при точке близкой к кипению вновь растворяются.
По иммунохимической классификации выделяют 5 основных типов миеломы: G, A, D, Е и Бенс-Джонса (обнаруживаются только легкие цепи – «болезнь легких цепей»). К редким формам относятся несекретирующая миелома (1-3%), М-миелома, биклональная миелома (2-4%). Частота встречаемости типов миеломы примерно соответствует концентрации различных классов иммуноглобулинов в сыворотке крови: G-миелома обнаруживается в среднем в 60% случаев, А-миелома — в 25%, D-миелома — в 1%, Е- миелома 1%. М-миелома и несекретирующая форма встречаются очень редко. Чаще встречаются G- и A-миелома, миелома Бенс-Джонса (15-20%). При несекретирующей миеломе для диагностики используют определение бета-2-микроглобулина.
Легкие цепи каппа и лямбда в молекуле парапротеинов распределяются приблизительно равномерно, как и при парапротеинемии Бенс-Джонса, при D-миеломе обычно обнаруживают лямбда-цепи.
У части пациентов миеломные клетки продуцируют только легкие цепи и не продуцируют тяжелых цепей. В этом случае говорят о болезни легких цепей или миеломе Бенс-Джонса. Эти цепи обнаруживаются в моче при отсутствии патологических иммуноглобулинов в сыворотке крови. Примерно у 30% больных обнаруживаются легкие цепи в моче — легкие цепи каппа. Обнаружение белка Бенс-Джонса, типа лямбда является худшим прогностическим признаком, поскольку этот белок более нефротоксичен (приводит к развитию почечной недостаточности) чем белок каппа.
Следует учитывать, что обнаружение парапротеинов увеличивается после 50 лет и достигает 4-7 % у лиц старше 65 лет (моноклональная гаммапатия невыясненного значения). Этот термин указывает на случаи парапротеинемии без других признаков плазмаклеточного или онкогематологического заболевания.
Таким образом, при ряде заболеваний в сыворотке крови появляется большее количество какого либо из класса иммуноглобулинов (их еще называют парапротеины) на фоне присутствия и других видов иммуноглобулинов. При электрофорезе сыворотки,которая содержит нормальные иммуноглобулины, их миграция идет в виде широкой, размытой полосы, а моноклональные (парапротеины) — проявляются в виде более узкой и четко очерченной. Моноклональные иммуноглобулины в силу своей однородности мигрируют при электрофорезе с образованием четко сформированной полосы, которую называют М-градиент.
Материал: Cыворотка крови, суточная моча.
Метод: Иммунофиксации в агарозном геле.
Тест – система: HELLABIO.
Референсные значения (норма): Не обнаружено.
Основные показания к назначению анализа:
1. Диагностика миеломной болезни;
2. Макроглобулинемия Вандельстрема;
3. Амилаидоз;
4. Болезнь тяжелых цепей.
Понижение значения:
1. Свидетельствует об эффективности терапии.
источник
Скрининг миеломной болезни и парапротеинемий (иммунофиксация сыворотки крови с пентавалентной сывороткой)
Данный тест предназначен для обнаружения моноклонального иммуноглобулина (парапротеина) с помощью сочетания таких методов, как клинический электрофорез и иммунофиксация. В результате разделения белков сыворотки крови путем электрофореза парапротеин (также его называют М-пиком Или М-градиентом) претерпевает миграцию в виде компактной полосы, что делает его заметным на фоне других белков фракций. Метод иммунофиксации позволяет достоверно выявить моноклональный иммуноглобулиновый компонент и определить его абсолютное содержание в сыворотке крови.
Электрофоретическое разделение белков сыворотки крови, клинический электрофорез и иммунофиксация, скрининг болезни Рустицкого-Калера, скрининг миеломы, скрининг миеломатоза, скрининг ретикулоплазмоцитоза, скрининг генерализованной плазмоцитомы.
Синонимы английские
Serum protein electrophoresis , immunofixation electrophoresis, multiple myelomascreening, plasmacellscancerscreening, plasmacell myeloma screening, monoclonal gammopathy screening.
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Диагностика миеломной болезни проводится с помощью симбиоза двух методов исследования – клинического электрофореза и иммунофиксации – и заключается в выявлении присутствия парапротеина в сыворотке крови для его последующего типирования. С помощью данного исследования можно выявить не только миеломную болезнь, но и другие лимфопролиферативные заболевания, а также амилоидоз, полинейропатию, гемолитические анемии, криоглобулинемию, поражения почек.
Основным признаком данных заболеваний с точки зрения лабораторной диагностики является увеличение синтеза иммуноглобулина. Метод электрофореза позволяет разделить белки сыворотки крови и выделить иммуноглобулин – в результате расщепления он выделяется на фоне других белковых фракций в виде мигрирующей полосы. Этот иммуноглобулин называется парапротеином (также его называют моноклональным иммуноглобулином, М-пиком или М- градиентом). Именно он является онкомаркером при наличии у пациента гематоонкологических заболеваний.
Клинические проявления миеломной болезни связаны с разрушением костей – это могут быть патологические переломы, боли в костях, анемический синдром, снижение гемоглобина в крови, синдром гипервязкости, тромбозы и кровотечения. Разрушение костей приводит к увеличению количества кальция в крови, что в свою очередь влечет за собой кальциевые отложения в почках, легких и на слизистой желудка. Также при миеломной болезни наблюдаются частые бактериальные инфекции у пациента – это связано с падением количества нормальных иммуноглобулинов и нарушениями процесса образования антител.
Наличие множественной миеломы напрямую связано с пролиферацией плазмацитов, способных секретировать парапротеин или его фрагменты. На момент диагноза концентрация моноклонального иммуноглобулина в сыворотке крови чаще всего превышает 25 г/л. Контроль и наблюдение за изменением уровня концентрации парапротеина позволяет проводить мониторинг состояния пациента и оценку эффективности лечения миеломы. При наличии заболевания контрольные анализы для наблюдения за изменением уровня концентрации парапротеинана на фоне терапии должны проводиться каждые 3 месяца.
При миеломе парапротеин в сыворотке крови в 60 % случаев представлен IgG, 20 % приходится на IgA. Эти 20 % относятся к определению миеломы Бенс-Джонса – в этом случае необходимо также проконтролировать продукцию свободных легких цепей (каппа или лямбда) и их наличие в моче. Достаточно редко (в 2–4 % случаев) при наличии миеломы может также отмечаться присутствие биклонального парапротеина.
Лимфома, при которой активно продуцируется моноклональный IgM, называется макроглобулинемией Вальденстрема. При данном типе лимфомы опухолевые клетки диффузно распределяются в селезенке, костном мозге и лимфоузлах. Увеличивается вязкость крови и проявляется ряд клинических симптомов: слепота, спутанность сознания, склонность к кровоточивости, гипертензия, сердечная недостаточность – это связано с повышением концентрации моноклонального IgM до 30 г/л и более. При других типах лимфомконцентрация парапротеинов класса IgM обычно не превышает 30 г/л, хотя они и обнаруживаются у 20 % пациентов.
Помимо перечисленного, моноклональный парапротеин может быть обнаружен при некоторых неопухолевых заболеваниях. Это может быть эссенциальная криоглобулинемия, парапротеинемическая хроническая полинейропатия, холодовая гемолитическая анемия, АL-амилоидоз почек и внутренних органов, болезнь отложения легких цепей. Также парапротеин в сыворотке крови обнаруживается при болезни Кастелмана, POEMS-синдроме и микседематозном лишае.
В случае если парапротеинемия не прогрессирует во множественную миелому или другое заболевание в течение 5 лет, речь идёт о доброкачественной парапротеинемии. В этом случае концентрация парапротеина обычно ниже 3 г/л.
Согласно статистике, парапротеинемия чаще всего выявляется у пациентов старше 50 лет. У лиц старше 65 лет выявляемость заболевания достигает 4-10 %. В большинстве случаев это бессимптомные моноклональные гаммапатии невыясненного значения (МГНЗ) – это парапротеинемия без других признаков онкогематологического заболевания. В этом случае не требуется постоянный мониторинг концентрации.
При выявлении парапротеинемии у пациентов моложе 50 лет необходимо проводить контрольные повторные обследования. Это связано с повышенным риском развития множественной миеломы. В случае обнаружения концентрации парапротеина выше 15 г/л необходимо провести ряд дополнительных исследований: электрофорез 24-часового образца мочи и иммунофиксация каждые 3-6 месяцев.
Для чего используется исследование?
- Диагностика причины клинической симптоматики (болей в спине, спонтанных переломов, частых бактериальных инфекций, полиневрита, гемолитической анемии, нефротического синдрома, кожной пурпуры, синдрома повышенного СОЭ, гиперкальциемии, амилоидоза внутренних органов, эндокринопатии, органомегалии).
- Мониторинг уровня концентрации парапротеинов при моноклональнойгаммапатии невыясненного значения.
- Оценка эффективности проводимой терапии при миеломе и других гаммапатиях.
Референсные значения: парапротеина (IgG, A, M, каппа/лямбда) не обнаружено.
Парапротеин в сыворотке крови присутствует в случае наличия у пациента:
- транзиторной парапротеинемии;
- моноклональной гаммапатии невыясненного значения;
- доброкачественной парапротеинемии;
- парапротеинемической полинейропатии;
- криоглобулинемии;
- холодовой гемолитической анемии;
- AL-амилоидоза или болезни отложения легких цепей;
- миседематозного лишая;
- POEMS-синдрома (полинейропатии с органомегалией);
- множественной миеломы;
- макроглобулинемии Вальденстрема;
- лимфомы и ХЛЛ (хронического лимфолейкоза);
- болезни тяжелых цепей.
Отсутствие парапротеина в сыворотке крови позволяет практически полностью исключить вероятность диагноза «гаммапатия» (для подтверждения необходимо исключить присутствие белка Бенс-Джонса в моче).
Интерпретация результатов исследования не является диагнозом и содержит информацию для лечащего врача для использования информации наряду с другими источниками (анамнеза, истории болезни, других исследований).
[40-063] Клинический и биохимический анализ крови — основные показателиКто назначает исследование?
Онколог, терапевт, гематолог, нефролог, уролог.
1. Лапин С.В. Тотолян А.А. Иммунологическая лабораторная диагностика аутоиммунных заболеваний. Издательство»Человек», СПб- 2010.
2. Tietz Clinical guide to laboratorytests. 4-th ed. Ed. Wu A.N.B.- USA,W.B Sounders Company, 2006,1798 p.
3. Conrad K, Schlosler W., Hiepe F., Fitzler M.J. Autoantibodies in Organ Specific Autoimmune Diseases: A Diagnostic Reference/ PABST, Dresden – 2011.
4. Conrad K, Schlosler W., Hiepe F., Fitzler M.J. Autoantibodies in Systemic Autoimmune Diseases: A Diagnostic Reference/ PABST, Dresden – 2007.
5. Gershvin ME, Meroni PL, Shoenfeld Y. Autoantibodies 2 nd ed./ Elsevier Science – 2006.
6. Shoenfeld Y., Cervera R, Gershvin ME Diagnostic Criteriain Autoimmune Diseases / Human Press – 2008.
источник
Синонимы: Белковые фракции, Протеинограмма, Serum Protein Electrophoresis, SPE, SPEP
Научный редактор: М. Меркушева, ПСПбГМУ им. акад. Павлова, лечебное дело.
Октябрь, 2018.
Одним из основных компонентов крови является белок, который состоит из фракций (альбумина и нескольких видов глобулинов), образующих определенную формулу количественного и структурного соотношения. При воспалительных (острых и хронических) процессах, а также при онкологических патологиях формула белковых фракций нарушается, что позволяет оценить физиологическое состояние организма и диагностировать ряд серьезных заболеваний.
Под действием электрического поля (на практике применяется электрофорез) белок разделяется на 5-6 фракций, которые отличаются по местоположению, подвижности, структуре и доле в общей белковой массе. Самая главная фракция — альбумин — составляет более 40-60% объема общего белка сыворотки крови.
Другие фракции представляют собой глобулины:
К ним относятся белки острой фазы (быстрого реагирования):
- антитрипсин — блокирует протеолитические ферменты (при воспалительном процессе в легочной ткани подавляет функцию эластазы, предотвращая деградацию эластина в стенках альвеол и развитие эмфиземы легких);
- кислый гликопротеин (орозомукоид) — способствует фибриллогенезу;
- липопротеины отвечают за доставку липидов к другим клеткам;
- транспортные белки связывают и перемещают важные гормоны организма (кортизол, тироксин).
Также включают белки острой фазы:
- макроглобулин активизирует защитные процессы организма при инфекционных и воспалительных поражениях;
- гаптоглобин соединяется с гемоглобином;
- церулоплазмин определяет и связывает ионы меди, нейтрализует свободные радикалы и является окислительным ферментом для витамина С, адреналина;
- липопротеины обеспечивают перемещение жиров.
К этой группе относят белки:
- трансферрин — обеспечивает перемещение железа;
- гемопексин — препятствует потере железа, связывает гемоглобин, миоглобин, каталазу, доставляет их в печень, где происходит распад гема и связывание железа с ферритином.
- комплементы — участвуют в иммунном отклике;
- бета-липопротеины — перемещают фосфолипиды и холестерин;
- некоторые иммуноглобулины — также обеспечивают иммунную реакцию.
Фракция включает важнейшие белки иммуноглобулины разных классов (IgА, IgМ, IgЕ, IgG), которые являются антителами и отвечают за местный и общий иммунитет организма.
В результате развития острых или обострения хронических воспалительных заболеваний соотношение белковых фракций изменяется. Уменьшение количества того или иного вида белка может наблюдаться при иммунодефицитах, которые свидетельствуют о серьезных процессах в организме (аутоиммунные заболевания, ВИЧ, онкология и т.д.). Избыток зачастую свидетельствует о моноклональной гаммапатии (производство аномальных типов иммуноглобулинов). К последствиям гаммапатии можно отнести множественную миелому (рак плазматических клеток), макроглобулинемию Вальденстрема (опухоль костного мозга) и т.д. Также может возникнуть поликлональная гаммапатия (секреция аномального количества иммуноглобулинов). Результатом являются инфекционные болезни, аутоиммунные патологии, заболевания печени (например, вирусные гепатиты) и другие хронические процессы.
Исследование белковых фракций позволяет диагностировать синдром иммунодефицита, онкологические и аутоиммунные процессы.
Также врач может назначить протеинограмму в следующих случаях:
- оценка тяжести течения воспалительных или инфекционных процессов (в острой и хронической форме);
- диагностика заболеваний печени (гепатиты) и почек (нефротический синдром);
- определение продолжительности заболевания, формы (острая, хроническая), стадии, а также контроль эффективности терапии;
- диагностика моно- и поликлональных гаммапатий;
- диагностика и лечение диффузных поражений соединительной ткани, в том числе коллагенозов (ее системное разрушение);
- наблюдение пациентов с нарушенным метаболизмом, режимом питания;
- мониторинг состояния больных с синдромом мальабсорбции (нарушение пищеварения и всасывания питательных компонентов);
- подозрение на множественную миелому, характеризующуюся симптомами: хроническая слабость, лихорадка, частые переломы и смещения, ломота в костях, инфекционные процессы в хронической форме.
- При отклонениях в лабораторных анализах, позволяющих заподозрить множественную миелому: гиперкальциемии, гипоальбуминемии, лейкопении и анемии.
- При подозрении на недостаточность альфа-1-антитрипсина, болезнь Брутона и другие иммунодефициты.
Исследование белковых фракций в крови (протеинограмма) выявляют концентрацию общего белка, количественное соотношение альбуминов и глобулинов.
| Возраст пациента | Общий белок, г/л |
| До 6 месяцев | 44 – 76 |
| До 1 года | 51 – 72 |
| До 3 лет | 56 – 75 |
| До 18 лет | 60 – 80 |
| Старше 18 лет | 64 – 83 |
Референсный диапазон, используемый в лаборатории Инвитро 1 :
Нормы для белковых фракций в лаборатории Хеликс 1 :
| Компонент | Референсные значения |
| Альбумин, % | 55,8 — 66,1 % |
| Альфа-1-глобулин, % | 2,9 — 4,9 % |
| Альфа-2-глобулин, % | 7,1 — 11,8 % |
| Бета-1-глобулин, % | 4,7 — 7,2 % |
| Бета-2-глобулин, % | 3,2 — 6,5 % |
| Гамма-глобулин, % | 11,1 — 18,8 % |
Справочник Л.А.Даниловой, 2014 2 :
| Белковые фракции | Количество, % | Функции |
| Альбумины | 50 — 70 | Поддержание коллоидно-осмотического давления, резерв белков, связывание и транспорт жирных кислот, билирубина, альдостерона |
| Глобулины | 20 — 30 | |
| альфа-1-глобулины: | 3 — 6 | |
| альфа-1-гликопротеин кислый (орозомукоид) | 0,5 — 1,4 | Концентрация возрастает при воспалительных процессах |
| альфа-1-антитрипсин | 2,0 — 4,0 | Ингибитор протеолитических ферментов |
| тироксинсвязывающий белок | 0,01 — 0,02 | Связывает и транспортирует тироксин |
| ретинолсвязывающий белок | 0,03 — 0,06 | Транспорт ретинола (витамин А) |
| транскортин | 0,03 — 0,035 | Связывает и транспортирует кортизол и кортикостерон |
| альфа-2-глобулины: | ||
| церулоплазмин | 9 — 15 | Транспорт меди |
| гаптоглобин | Связывает гемоглобин | |
| альфа-2-макроглобулин | Ингибитор эдопептидаз | |
| бета-глобулины: | ||
| трансферрин | 8 — 18 | Транспортирует железо |
| гемопексин | Связывание гема | |
| бета-липопротеины (ЛПНП) | Транспорт липидов | |
| С-реактивный белок | Появляется при воспалительных процессах | |
| гамма-глобулины: | Антитела | |
| IgG | 15—25 | Специфическая гуморальная защита; активизирует систему комплемента |
| IgM | Участвует в первичном иммунном ответе | |
| IgA | Препятствует адгезии и адсорбции микробов на слизистые оболочки | |
| IgE | Участвует в противопаразитарном иммунитете и в аллергических реакциях | |
| IgD | В-клеточные рецепторы | |
Факторы влияния на результат
- Экспериментальные исследования показывают, что даже умеренный психологический стресс небольшой продолжительности может привести к значимым изменениям белковых фракций 3 .
- Гемолиз (искусственное или природное разрушение эритроцитов) может увеличить количество бета-глобулинов;
- Лечение пенициллином приводит к расщеплению альбуминов, что снижает их концентрацию в общем белке;
- Исследование с радиоконтрастными компонентами (ложный результат);
- Гемодиализ (метод внепочечного очищения крови) препятствует интерпретации теста;
- Плазмаферез (очищение крови от токсинов) снижает количество гамма-глобулинов;
- Наличие множественной миеломы (в 10% случаев соотношение белковых фракций остается в нормальных пределах);
- Нарушение правил подготовки тесту и процедуры забора крови.
| Повышение значений | Понижение значений |
| Альбумин | |
|
|
| Альфа-глобулины | |
|
|
| Бета-глобулины | |
|
|
| Гамма-глобулины | |
|
|
Расшифровку результата анализа на белковые фракции может проводить врач-гематолог, а также онколог, терапевт, хирург и т.д.
Биоматериал для исследования – сыворотка венозной крови.
Метод забора – венепункция локтевой вены.
Время забора крови – утренние часы (до 11.00).
Обязательное требование – процедура проводится строго натощак!
Дополнительные требования к подготовке
- За 2 недели до теста необходимо исключить прием следующих лекарств:
- оральные контрацептивы;
- фенитоин;
- гормоны (тестостерон, эстроген, андрогены);
- аспарагиназа;
- глюкокортикоиды;
За 3 дня до теста нельзя менять меню и режим питания (запрещены диеты, голодания, посты, переход на вегетарианство и т.д.);
Накануне венепункции исключить из рациона жирные, копченые и острые продукты, жареные блюда, алкоголь и энергетики;
В день анализа можно пить только воду без газа;
За 1-3 часа до забора крови не рекомендуется курить.
Важно! Лечащему врачу необходимо заранее сообщить о текущем или недавно законченном приеме каких-либо лекарственных препаратов, витаминов, биологически активных добавок (с указанием их названия, дозировок, продолжительности лечения).
- 1. Данные лабораторий Инвитро и Хеликс.
- 2. Л.А.Данилова, д.м.н., проф. Анализы крови, мочи и других биологических жидкостей человека в различные возрастные периоды, — СпецЛит, 2014г.
- 3. Van Hunsel F. The influence of psychological stress on total serum protein and patterns obtained in serum protein electrophoresis. — Psychological medicine, Mar, 1998.
- 4. Sherilyn Alvaran Tuazon, MD. Serum Protein Electrophoresis. — Medscape, Sep, 2014.
Важно! Все материалы носят справочный характер и ни в коей мере не являются альтернативой очной консультации специалиста.
Этот сайт использует cookie-файлы для идентификации посетителей сайта: Google analytics, Yandex metrika, Google Adsense. Если для вас это неприемлемо, пожалуйста, откройте эту страницу в анонимном режиме.
источник
В плазме человеческой крови находится множество белковых компонентов. Они различны по своему составу, строению и подвижности в определенной среде, проводящей электрический ток. На этом и строится разделение общего белка, который локализуется в плазме, на различные белковые фракции. При проведении электрофореза сыворотки крови выясняют количественное отношение отдельных белковых составляющих и структур. Это необходимо для определения наличия у человека различных патологических явлений, например инфекций или онкологии. Именно электрофорез белков сыворотки крови имеет большое значение при проведении диагностики различных болезней.
Для расщепления белковых фракций применяют электрофорез сыворотки крови, принцип которого основан на разной подвижности белковых компонентов в созданном электрическом поле. Такой метод исследования является более точным и информативным, в отличие от стандартного общего анализа крови. Но при этом электрофорез показывает только количество определённой фракции белка, характер и степень патологического процесса в общей форме. Анализ проведенных исследований позволяет медицинским специалистам выяснить, какое именно соотношение белковых фракций наблюдается в организме человека, и определить специфику патологии, присущую конкретному заболеванию.
Большую часть основной биологической жидкости человека, или крови, составляют белки. В общем количестве их норма находится в пределах 60-80 г/л. Для получения точного анализа проводится электрофорез сыворотки крови на бумаге. Это исследование является самым распространенным способом анализа. Основной средой является особая фильтровальная бумага. Главная ее особенность – высокая гигроскопичность. Такая бумага может поглотить воды больше своего веса в 130-200 раз. В зависимости от применяемого оборудования электрофорез на бумаге длится 4-16 часов. Происходит подразделение белковых структур. Затем полосы бумаги обрабатывают специальными красками для получения анализа. Такая методика является самой распространенной в работе медицинских лабораторий. За счёт воздействия электрического тока белковые фракции, заряженные отрицательно, двигаются в сторону положительно заряженного электрода. Благодаря этому белковые составляющие крови подразделяются на 5 известных фракций:
Альбумины заряжены отрицательно, имеют маленькую, по сравнению с другими фракциями, молекулярную массу. За счет этого скорость их передвижения гораздо выше, чем у остальных фракций, и они дальше всех локализуются от участка старта. Первые три фракции глобулина передвигаются с более низкой скоростью из-за своей массы. Но самая маленькая скорость регистрируется у γ-глобулинов. Эти белки имеют большую массу и крупные, относительно других, размеры. Их заряд почти нейтрален, поэтому данная белковая фракция практически не сдвигается с линии старта.
В настоящее время электрофорез сыворотки крови часто проводимый анализ для постановки точного диагноза болезни. Этот анализ могут назначить как терапевты, так врачи узкого профиля. Показаниями по проведению исследований будут:
- различные воспаления;
- болезни хронической природы;
- патологические процессы в соединительной ткани;
- внутреннее кровотечение;
- злокачественные новообразования.
Для того чтобы полученные результаты поведенных исследований были верными, не менее чем за 8 часов до сдачи крови необходимо отказаться от приёма еды. Кроме того, необходимо согласовать прием лекарственных средств, если таковые имеются, с лечащим врачом.
Для того чтобы результаты не были по ошибке завышены, необходимо снизить до минимума возможность свертывания крови для определения показателя белковых фракций и общего белка. Электрофорез сыворотки крови проводится аккуратно, поскольку существует вероятность искажения полученных результатов из-за фибриногена. Он может прятать ненормальные белки или быть спутанным с ними.
В течение суток после сдачи пробы будет готов анализ на электрофорез белков сыворотки крови. Норма полученных показателей по категориям у взрослых людей:
- Общий белок – 63-82 г/л.
- Альбумины – 40-60 % от общего количества фракций.
- α1-глобулины – 2-5 %.
- α2-глобулины – 7-13 %.
- β-глобулины – 8-15 %
- γ-глобулины – 12-22 %.
Изменение количества любой белковой фракции в большую или меньшую сторону может свидетельствовать о развитии той или иной патологии. Для получения достоверной информации об этом необходим электрофорез белков сыворотки крови. Расшифровка результатов облегчит медицинским специалистам постановку диагноза и выбор лечения.
В самом начале при анализе полученных результатов определяют количество альбумина. Увеличение этой фракции может говорить об обезвоживании. Такое может произойти, если у больного отмечается затяжная рвота или нарушения в пищеварительной системе. Также увеличение альбумина происходит при ожогах большой площади кожного покрова.
Гораздо опаснее, если в организме снижается количество альбуминов, это может говорить о следующих патологиях:
- Поражения почек и печени.
- Патологии желудочно-кишечного тракта.
- Инфекционные процессы.
- Нарушения в деятельности сердечно-сосудистой системы.
- Кровотечения.
- Злокачественные новообразования.
- Сепсис.
- Ревматизм.
Незначительное уменьшение количества альбуминов может быть также:
- У будущих матерей.
- При превышении дозы лекарственных препаратов.
- При длительной лихорадке.
- У заядлых курильщиков.
Уменьшение количества a1-глобулинов регистрируется при недостатке α1-антитрипсина. Увеличение же отмечают при обострении воспалений в организме, нарушениях в работе печени, при тканевом распаде.
Регистрируют его при сахарном диабете, воспалительных процессах в поджелудочной железе, у новорожденных детей при желтухе, при гепатитах токсического происхождения. Свидетельствует оно и о неправильном, несбалансированном питании.
Происходит при наличии следующих заболеваний:
- Воспаления, особенно с присутствием гнойного экссудата (воспаление легких и другие процессы с наличием гноя).
- Поражения соединительной ткани (например, ревматизм).
- Злокачественные новообразования.
- Периоды восстановления после ожогов.
- Поражение почек.
Кроме того, такое явление характерно для гемолиза крови в пробирке во время проведения исследования.
Проявляется при гиперлипопротеидемии (увеличении количества липидов в крови), патологиях печени и почек. Можно обнаружить при открытой язве желудка, а также гипотиреозе (нарушение работы щитовидной железы). Снижение фракции регистрируют при гипобеталипопротеинемии (повышение в крови компонента беталипопротеин).
Эта фракция включает в свой состав иммуноглобулины. Поэтому увеличение γ-глобулинов регистрируется при сбоях в иммунитете. Обычно это происходит при различных инфекциях, развитии воспалительного процесса, изменениях ткани и ожоговых поражениях. Рост γ-глобулинов отмечают у больных хронической формой гепатита. Практически такая же картина характерна для цирроза печени. При запущенных случаях данного заболевания количество белковой фракции γ-глобулинов значительно выше показателя альбуминов. При определенных болезнях могут возникать сбои в образовании γ-глобулинов, и происходит развитие измененных протеинов в крови – парапротеинов. Для выяснения характера такого развития производится дополнительное исследование – иммуноэлектрофорез. Такая картина характерна для миеломного заболевания и патологии Вальденстрема.
Увеличение количества γ-глобулинов также присуще следующим патологиям:
- красной волчанке;
- эндотелиоме;
- ревматоидной форме артрита;
- остеосаркоме;
- хронической форме лимфолейкоза;
- кандидомикозу.
Снижение показателя γ-глобулинов подразделяют на 3 вида:
- Физиологический (характерен для детей в возрасте от трех до пяти месяцев).
- Врожденный (развивается с момента рождения).
- Идиопатический (когда причину развития установить не удается).
Вторичное снижение регистрируется при развитии заболеваний, которые вызывают истощение иммунной системы. В последнее время в медицинской практике все чаще проводится анализ на определение количества преальбуминов. Обычно такое исследование проводят больным, находящимся в реанимации.
Уменьшение количества преальбуминов очень важный и точный тест на определение недостаточности белковых структур в организме пациента. При проведении анализа на преальбумины выполняют коррекцию белкового метаболизма у таких пациентов.
Принцип проведения подобного анализа схож с технологией выполнения электрофореза сыворотки крови. Проводят его для более точной постановки диагноза или обнаружения других патологий. Кроме того такой анализ поможет выявить у больного наличие протеинурии.
Электрофорез сыворотки крови и мочи – важные методы в диагностике различных инфекционных заболеваний. Благодаря методике исследования и высокой точности они помогают определить вид патологии. Точный диагноз – верный путь к правильному лечению и полному выздоровлению.
источник
Кровь представляет собой соединительную ткань, состоящую из жидкой среды, иначе называемой плазмой, клеток в ней, представленных лейкоцитами, а также структур без ядра – эритроцитов и тромбоцитов. Она осуществляет ряд жизненно важных для организма функций:
— обогащает клетки кислородом;
— способствует обогащению тканей питательными веществами;
— регулирует температуру организма;
— защищает от бактерий, вирусов и грибков.
Плазма является жидким бесцветным раствором крови, имеющим сложный состав, в котором растворены все питательные вещества организма. Она состоит на 90% из воды и на 10% из форменных элементов, представленных в виде белков, липидов, углеводов и минеральных веществ. Плазма способствует разжижению крови и делает ее консистенцию оптимальной для того, чтобы транспортировать важные питательные элементы и вещества ко всем клеткам организма.
Если из плазмы удалить фибриноген, компонент, отвечающий за свертываемость крови, то получится сыворотка крови. Она применяется для переливания после хирургического вмешательства, а также в акушерстве и гинекологии.
Это жидкость желтоватого цвета, отделенная от кровяного сгустка. Ее специфический цвет свидетельствует о наличии в ней жёлчного пигмента – билирубина. Применяется для биохимических анализов, исследования на наличие разного рода инфекционных заболеваний, для оценивания результативности вакцинации. Сыворотка крови человека или животного, иммунизированная определенным антигеном, может стать иммунной сывороткой, применяемой для диагностики и лечения ряда болезней. Ее также применяют для определения группы крови. Для клинических практик используют свежую или предварительно замороженную кровяную сыворотку.
Сыворотка крови может быть получена несколькими способами:
— В термостате, куда помещается стерильно взятая кровь на полчаса. После этого при помощи пипетки отслаивается сгусток от стенки пробирки и размещается в холодильнике. Оставшаяся сыворотка сливается или отсасывается в стерильную пробирку.
— Путем нейтрализации элементов фибриногенов с помощью ионов кальция, за счет чего резко увеличивается стабильность.
— Путем естественного свертывания получают так называемую нативную сыворотку.
Анализ сыворотки крови можно осуществить путем биохимического анализа, что позволяет понять, как работают внутренние органы. Стандартный анализ показывает состояние и количество белков, углеводов, липидов, минерального обмена.
Правильная трактовка полученных результатов анализа и знание стандартных показателей дает возможность четко установить все дисбалансы, нарушения и воспалительные процессы в организме и расскажет о состоянии внутренних органов.
Исследование сыворотки крови начинается со сдачи общего анализа. Анализ на общий белок покажет количество всех белков (альбумина и глобулина), содержащихся в сыворотке. Норма белков и аминокислот для младенцев до 1 месяца колеблется в пределах 46,0 – 68,0 г/л, для детей до года – 48,0 – 76,0 г/л. Белки сыворотки крови для детей в возрасте до 16 лет должный иметь показатели 60,0-80,0 г/л, у взрослых – 65,0-85,0 г/л.
Количество белка может меняться в зависимости от положения тела и физической активности. При подъеме тела количество белков увеличивается на 10% в течение получаса, активная физическая работа заставляет меняться показатели в пределах 10%. Пережатие вены и работа рукой в процессе забора крови могут также дать завышенные показатели.
Белки плазмы синтезируются клетками печени. Анализ показывает уровень содержания:
Анализ сыворотки крови покажет пониженное содержание белка, если возникает недостаточное его поступление в организм вследствие голодания или соблюдения диеты без белков. Причиной снижения уровня может послужить рак печени или другое воспалительное заболевание этого органа, новообразования, ожоги и другие заболевания, спровоцированные повышенной потерей белка.
Последствием дегидратации после травмы или ожога может стать повышение концентрации белка. Возникновение острой инфекции приводит к повышению показателей, связанных с обезвоживанием организма. При этом уровень белков может нормализоваться самостоятельно, что будет свидетельствовать о процессе выздоровления.
Сыворотка для распознания группы крови должна быть стандартной, то есть определенной группы, приготовленной из человеческой крови. Для теста необходимо подготовить сухое предметное стекло, стандартную сыворотку трех групп крови, раствор хлорида натрия, вату, стеклянные палочки и пипетки.
Сыворотка крови — это не просто сложная смесь способная рассказать о состоянии организма, но и важный элемент большинства противовирусных лекарств.
источник
Прямыми показаниями к иммунохимическому исследованию принято считать клинические и лабораторные признаки, которые могут быть проявлением как непосредственно В-клеточных лимфопролиферативных заболеваний (в первую очередь парапротеинемических гемобластозов), так и связанной с ними белковой патологии.
Один из самых частых лабораторных признаков, заставляющих предположить наличие парапротеинемии, — повышение СОЭ (особенно не связанное с реактивными состояниями и другими очевидными причинами), которое в данном случае является результатом увеличения глобулиновой фракции сыворотки крови за счет моноклонального иммуноглобулина. Следует отметить, что белок Бенс-Джонса, который является микроглобулином, не отражается на уровне СОЭ, что в части случаев вызывает диагностические затруднения и неоправданный отказ от исследований для выявления моноклональной секреции.
Другой широко известный симптом парапротеинемии — повышение уровня общего белка сыворотки крови за счет фракции глобулинов. Необходимо помнить, что это не абсолютный признак и связан он с далеко зашедшим заболеванием, когда масса опухоли значительна. Выраженные поликлональные гипергаммаглобулинемии характеризуются такой же биохимической картиной.
Еще одно проявление парапротеинемии — синдром гипервязкости. Его развитие обусловлено не только общим содержанием М-компонента, но и качеством моноклонального иммуноглобулина: высокомолекулярные парапротеины (IgM, полимерный IgA), а также белки, склонные к образованию крупных циркулирующих агрегатов (например, моноклональный IgG3), наиболее часто приводят к появлению гипервязкости. Описаны единичные случаи развития синдрома гипервязкости при миеломе Бенс-Джонса к-типа. В этих случаях моноклональные L-цепи проявляли необычную способность к агрегации, образуя комплексы с молекулярной массой до нескольких миллионов дальтон.
Такие состояния, как упорная протеинурия, особенно в отсутствие клеточного осадка, острая или хроническая почечная недостаточность, могут быть первыми симптомами секреции белка Бенс-Джонса. При этом отсутствуют такие привычные признаки миеломной болезни, как повышение СОЭ и гиперпротеинемия, а протеинурия может быть минимальной и ошибочно оценивается как проявление пиелонефрита. В таких случаях диагностика очень сложна, тем более что пациенты этой группы, как правило, попадают под наблюдение гематолога поздно, а в основном находятся на лечении в нефрологических отделениях.
При клинических проявлениях холодовой гемагглютинации пациент должен быть обследован на наличие моноклонального макроглобулина, практически всегда к-типа, проявляющего антительную активность по отношению к I-антигену мембраны эритроцитов. Оптимум активности этих антител приходится на температуру ниже температуры тела, чем и объясняются особенности клинической картины этого заболевания. Синтез моноклональных Холодовых агглютининов может быть связан с лимфопролиферативным процессом. В таких случаях секреция, как правило, очень незначительна и при рутинном исследовании в биохимической лаборатории обычно не выявляется.
Наличие клинических и лабораторных признаков криоглобулинемии должно насторожить в отношении моноклональной секреции, поскольку почти в половине случаев криоглобулинемия зависит от присутствия парапротеина в сыворотке крови. Тяжесть клинической симптоматики обусловливается не столько концентрацией криоглобулина, сколько температурой осаждения. В то же время установлено, что при повышении концентрации криоглобулинов температура криопреципитации может повышаться, приближаясь к температуре тела.
Электрофоретическое разделение плазмы здорового взрослого в геле агарозы.
1 — преальбумин; 2 — антихимотрипсин; 3 — церулоплазмин; 4 — фибронектин; 5 — С4 (4-й компонент комплемента); 6 — старт; 7 — С-реактивный белок; 8 — лизоцим; Альб. — альбумин; a1-Лп — а1-липопротеин; а1-Ат — а1,-антитрипсин; Ор— орозомукоид; a2-М — а2-макроглобулин; Гг2„, — гаптоглобин 2—2; р-Лп — р-липопротеин; Тф — трансферрин; Гп — гемо-пексин; C3 — 3-й компонент комплемента; Фб — фибриноген. Анод слева.Криоглобулинемия I типа выявляется главным образом при миеломной болезни или макроглобулинемии Вальденстрема. Симптоматика связана с отложением криопреципитата в основном в сосудах кожи, что приводит к развитию геморрагического или язвенно-геморрагического васкулита, синдрома Рейно. Криоглобулинемия II типа, при которой парапротеин обладает активностью ревматоидного фактора, ассоциируется с лимфомами, хроническим лимфолейкозом, макроглобулинемией Вальденстрема, миеломной болезнью. Кроме того, она может быть связана с инфицированием вирусом гепатита С или В. Среди клинических проявлений отмечаются характерные признаки иммунокомплексной патологии: васкулит, артрит, гломерулонефрит.
В ряде случаев первым и некоторое время единственным проявлением заболевания, сопровождающегося моноклональной секрецией, может быть развитие AL-амилоидоза с характерной для него клинической картиной. В состав амилоида данного вида входят моноклональные L-цепи или их вариабельные районы (VL), причем преобладают Х-цепи, которые встречаются приблизительно в 2 раза чаще, чем к-цепи. Именно в составе амилоида была идентифицирована новая подгруппа Х-цепей (XVI), которая особенно часто является причиной развития AL-амилоидоза.
При исследовании аминокислотного состава амилоида и белков-предшественников обнаружено замещение части гидрофильных аминокислотных остатков в консервативной области вариабельных доменов на гидрофобные, что сказывается на ухудшении растворимости белка и склонности к образованию агрегатов. Присущая таким белкам «амилоидогенность» была продемонстрирована в опытах in vivo: при введении мышам очищенных белков Бенс-Джонса, полученных от больных с амилоидозом, развивался типичный амилоидоз, причем в состав амилоида входили введенные моноклональные L-цепи.
Типичным показанием к проведению иммунохимического исследования являются остеодеструкции плоских костей, особенно единичные и труднодоступные для биопсии.
Неясные по происхождению плазмоцитозы костного мозга, особенно при умеренном повышении содержания плазматических клеток, также нуждаются в иммунохимической характеристике при проведении дифференциальной диагностики.
Подозрение на наличие М-градиента при рутинном лабораторном исследовании (ЭФ в биохимической лаборатории) должно служить поводом для развернутого иммунохимического исследования, учитывая рассмотренные ранее случаи возникновения ложных М-градиентов.
Частые инфекции легких, верхних дыхательных путей, мочеполовой системы (иногда в дебюте заболеваний, связанных с В-клеточной пролиферацией) следует расценивать как проявление вторичной гипогаммаглобулинемии. Ее генез сложен и связан как со снижением количества нормальных В-клеток, так и с нарушением межклеточных взаимодействий, регулирующих синтез иммуноглобулинов. При рецидивирующих, плохо поддающихся лечению инфекционных осложнениях пациент нуждается как минимум в оценке уровня сывороточных иммуноглобулинов.
Кроме того, перед назначением заместительной терапии препаратами у-глобулинов, особенно вводимыми внутривенно, при любых заболеваниях необходимо исследование сывороточных иммуноглобулинов для исключения первичного селективного IgA-дефицита. Этот самый распространенный из первичных гуморальных иммунодефицитов (частота в популяции достигает 1:700) в ряде случаев протекает бессимптомно. Повторное введение таким больным препарата у-глобулина, содержащего чужеродный для них белок IgA, приводит к развитию выраженных реакций.
Иммунохимические исследования периодически проводят в ходе лечения больных парапротеинемическими гемобластозами и с другими секретирующими В-клеточными опухолями для оценки эффективности лечения, а также пациентам с моноклональными гаммапатиями неясного генеза (МГНЗ).
источник
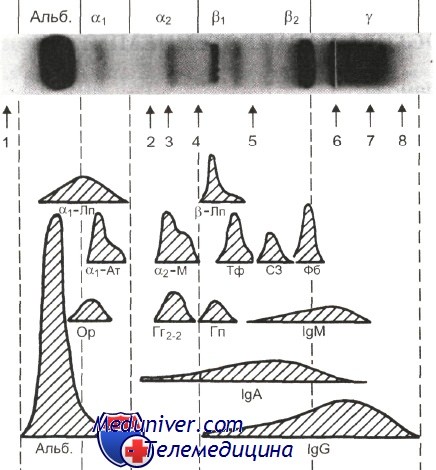 Электрофоретическое разделение плазмы здорового взрослого в геле агарозы.
Электрофоретическое разделение плазмы здорового взрослого в геле агарозы.