Высокая специфичность антител в отношении антигена превращает их в мощный инструмент для идентификации различных веществ, будь то макромолекулы, клеточные фрагменты или целые клетки.
Начало широкому использованию антител в диагностических целях положил в 1955 году американский иммунолог А. Кунс. Он присоединил к антителам светящийся краситель. Флюоресцирующие антитела сделали видимыми места расположения интересующих его молекул в клетке. Этот метод получил название иммунофлюоресцентного. Чувствительность метода можно повысить несколькими путями.
В первом случае иммунный ответ усиливается за счет применения антител нескольких порядков:
Антиген иммобилизуется на подложке, к нему добавляются антитела 1-го порядка, связывающиеся непосредственно с антигеном. В исследуемый образец добавляются антитела 2-го порядка, связывающиеся с антигенными детерминантами антител 1-го порядка. Антитела 2-го порядка имеют флюоресцирующую (или другую) метку. Поскольку участков связывания может быть несколько, то реакция проявляется более отчетливо.
Другая система усиления сигнала основана на высоком сродстве биотина (низкомолекулярного растворимого витамина) к стрептавидину (бактериальному белку). Здесь возможны два варианта:
А. Если возможно ковалентно связать биотин непосредственно с антителами, то стрептавидин метят маркером и используют аналогично антителам второго порядка:
Б. Система “биотин-антитело + стрептавидин + меченый биотин”:
В этом случае образуется целая сеть из молекул стрептавидина, связанного с меченым биотином. Следовательно, происходит многократное усиление сигнала.
Применение антител второго и третьего порядков позволяет также упрощать процедуру определения микроорганизмов в мазке. При этом не обязательно иметь меченые антитела против всех бактерий. Достаточно иметь обычные антитела кролика или мыши против интересующего микроорганизма и меченые МКА против этих иммуноглобулинов. Если микроорганизм в мазке присутствует, то к нему “приклеятся” специфические антитела, а к ним уже — меченые. В результате мазок будет светится при люминесцентной микроскопии. Фотометрические или флуоресцентные методы могут быть использованы не во всех случаях, например, если измерение проводят очень мутной среде.
Кроме красителя в качестве метки можно использовать фермент (иммуноферментный анализ) или радиоактивный изотоп (иммунорадиологический). От чувствительности детекции маркера зависит чувствительность метода анализа.
Радиоактивные метки.
Выбор маркера и способа его «привязки» к антигену является одним из важных этапов в проведении анализа. Первоначально широко применялись радиоизотопные метки (радиоиммунный анализ — РИА), предложенные американскими исследователями (С. А. Берсон, Р. С. Ялоу, 1959). Однако в последние годы все более широкое использование в Качестве маркеров находят ферменты. Это обусловлено рядом принципиальных трудностей, связанных с применением изотопныx маркеров. Так, изотоп 125 I имеет время полураспада 60 суток, чем ограничивается срок его использования. Изотоп 3 Н имеет длительное время жизни (12.5 лет), однако под действием бэта-излучения происходит распад молекул антигена, в результате чего время жизни меченых 3 Н-соединений тоже ограничено. Кроме того, эффективность счета трития существенно ниже, чем 125 I. Ограничивающими факторами РИА являются сложность и высокая стоимость оборудования, необходимость централизованной системы распределения иммунохимических наборов, меченных радиоактивными изотопами, определенная опасность изотопов для окружающей среды. Учитывая трудности использования радиоизотопных меток, были предложены в качестве маркеров ферменты.
При иммуноферментном анализе антиген связывается с поверхностью лунки полистирольного планшета. В лунку добавляют антитела, несущие фермент в качестве метки, инкубируют и отмывают. Далее приливают субстрат, который меняет окраску при взаимодействии с этим ферментом. Изменение окраски можно измерить с помощью спектрофотометрии. Таким способом проводится индикация и количественная оценка биоорганических соединений с чувствительностью до 10 -12 г/литр.
В настоящее время известно более 2000 разных ферментов, однако только некоторые находят применение в иммуноферментном анализе. Это объясняется высокими требованиями, предъявляемыми к свойствам ферментов. Фермент должен быть высоко активен, а продукты его реакции детектироваться с высокой чувствительностью, он должен быть стабилен, так чтобы его активность сохранялась не менее одного года. Содержание фермента-маркера в определяемом образце должно быть минимальным. Именно из-за этого для разных объектов используют разные ферменты. Во многих случаях, когда необходим качественный результат, оценка иммунохимической реакции может быть проведена визуально.
Для введения ферментативной метки разработано много разных химических, биохимических и иммунологических способов.
Первым реагентом, использованным для синтеза иммуноферментных конъюгатов, был глутаровый альдегид, реагирующий с аминогруппами лизина белковых молекул. С помощью глутарового альдегида получены конъюгаты антител и антигенов с пероксидазой, щелочной фосфатазой, глюкоамилазой. В настоящее время широко используются иммунопероксидазные конъюгаты и конъюгаты с бэта-галактозидазой.
Ковалентные методы получения иммуноферментных конъюгатов нашли весьма широкое распространение, однако к некоторых случаях действие сшивающего реагента отрицательно сказывается на ферментативной и иммунологической активности компонентов гибридной макромолекулы. В связи с этим определенный интерес представляют иммунологические методы введения ферментной метки.
Один из подходов получил название метода «гибридных антител». Ферментативным гидролизом получают Fab-фрагменты молекул антител против определяемого антигена и используемого фермента. Затем смесь продуктов гидролиза подвергают восстановлению меркаптоэтанодом; при этом Fab-фрагменты обратимо диссоциируют на симметричные части. После удаления восстанавливающего агента молекулы снова ассоциируют, образуя гибридные молекулы антител, специфичные к определяемому антигену и ферменту. При добавлении фермента образуется комплекс антитело—фермент (рис. 19, а). Гибридомная технология открывает принципиально новый путь получения гибридных антител, который заключается в том, что сливаются моноклональные клетки, специфичные против данного антигена и фермента-маркера, в результате чего образуются гибридомы второго поколения, синтезирующие антитела, с двумя специфичностями.
Другой путь заключается в том, что получают антитела одного и того же вида животного (например, кролика) против определяемого антигена и фермента, которые соединяют между собой через антитела другого вида животных (антитела барана против кролика). Добавление фермента к такой тройной молекуле также приводит к образованию комплекса антитело—фермент. В настоящее время разрабатываются подходы получения гибридных антител методами клеточной и генной инженерии, что позволит существенно упростить способ их получения.
Стабильность иммуноферментных конъюгатов при хранении — важнейший параметр, обусловливающий возможность их практического использования. Методы направленной стабилизации конъюгатов пока еще не разработаны. Не существует также корреляции между стабильностью конъюгатов и методом их получения. Однако высокая стабильность гибридных молекул обеспечивает их применение на практике и значительно превосходит стабильность антител и антигенов, меченных радиоактивными изотопами. В лиофилизованном состоянии ферментные конъюгаты сохраняют свои свойства до двух лет.
Кроме ферментов в качестве маркеров могут быть использованы субстраты. В частности, в иммунокофакторном анализе применяются в качестве меток АТФ и НАД, которые могут быть «пришиты» к молекуле антигена через адениновый остаток таким образом, что сохраняется их способность взаимодействовать с ферментом. Аналогично были использованы субстраты пероксидазы (люминол, изолюминол), которые могут быть окислены пероксидом водорода в реакции хемилюминесценции, катализируемой пероксидазой.
источник
Роза Ягудина о значении моноклональных антител в современной медицине и перспективах их применения
Моноклональные антитела (МАТ) сегодня применяются при лечении заболеваний, большинство из которых еще несколько десятков лет назад считались неизлечимыми. Это онкологические, аутоиммунные, сердечно-сосудистые и инфекционные заболевания, воспалительные реакции различного генеза, системный склероз, идиопатический фиброз легких, гепатит В, СПИД, ревматоидный артрит, системная красная волчанка, аллергические реакции, мышечная дистрофия, болезнь Альцгеймера, астма, диабет и другие заболевания.
Препараты, изготовленные на основе моноклональных антител, относятся к новейшим в современной медицине. С середины 90-х годов до сегодняшнего дня на мировом фармацевтическом рынке одобрено более 30 лекарственных средств, имеющих в составе моноклональные антитела. Первоначально надежность методов и технологий производства моноклональных антител и безопасность их применения вызывали опасения у фармацевтических производителей. Однако сегодня научный и медицинский опыт показал возможность их эффективного и безопасного применения в медицине. Сейчас большинство фармацевтических компаний работают над разработкой новых препаратов и лекарственных средств на основе моноклональных антител. На этапе разработки в мире находится около 300 МАТ.
В чем же уникальность и специфика применения моноклональных антител?
Роза Исмаиловна Ягудина , доктор фармацевтических наук, профессор, зав. кафедрой организации лекарственного обеспечения и фармакоэкономики, зав. лабораторией фармакоэкономических исследований Первого МГМУ им. И. М. Сеченова, г. Москва, главный редактор журналов «Фармакоэкономика» и «Современная организация лекарственного обеспечения».
Иллюстрации и примеры в статье взяты из: Ягудина Р.И., Тихомирова А.В. История развития моноклональных антител, их настоящее и будущее // Современная организация лекарственного обеспечения. – 2013. – №1. – 6–27
История получения и применения моноклональных антител уходит своими корнями в исследования конца 19 века. С тех пор, за прошедшие более чем сто лет, моноклональные антитела успели несколько раз совершить революцию в медицине, полностью перевернув представления о возможностях лекарственной терапии.
Ученых с давних пор интересовал вопрос о том, каким образом организм создает множество различных антител, обладающих уникальной специфичностью в отношении чужеродных веществ (антигенов), и каким образом эти антитела работают. Один из первых шагов к ответу на этот вопрос был сделан группой ученых, работавших в Институте инфекционных болезней в Берлине и открывших методы лечения дифтерии. В конце XIX века дифтерия у детей считалась смертельным неизлечимым заболеванием. Врач иммунолог-бактериолог Эмиль Беринг (Emil Behring) предположил, что лечение дифтерии может быть успешным в случае проявления естественной защитной реакции человеческого организма, а именно, если секретируемый дифтерийными бактериями токсин нейтрализовать. В 1890 г. Беринг совместно с японским ученым Сибасабуро Китасато установили, что неиммунизированные животные могут быть защищены от токсина дифтерийных бактерий с помощью инъекции антитоксина (антитоксической сыворотки) иммунизированных животных. В 1894 г. в период эпидемии дифтерии, унесшей жизни 50 000 детей в Германии, были произведены первые 25 000 доз антитоксина для применения в лечении людей. В 1901 г. Эмилю Берингу была присуждена Нобелевская премия за работу по сывороточной терапии. Однако на тот момент эффективность сыворотки была достаточно низкой, поскольку антитела в сыворотке вырабатывались клетками животных, а не самого пациента и вызывали лишь пассивный иммунитет. Антитоксин необходимо было вводить сразу после инфицирования, иначе было слишком поздно.
Еще одним примером использования антисыворотки в терапии людей стали исследования Чарльза Ричета (Charles Richet) и Жюля Эрикура (Jules Héricourt), применявших для лечения онкологических заболеваний антисыворотку, полученную путем иммунизации животных тканями саркомы. С середины 30-х годов практика пассивной иммунизации сошла на нет в связи с открытием антибиотиков широкого спектра действия.
В 30-х гг. появились ультрацентрифуги, позволявшие разделять антитела по размеру и форме. В 40-х гг. ученые научились сортировать антитела по электрическому заряду и размеру. Однако дальнейшая расшифровка структуры антитела была пока недоступна из-за их большого размера, в 20 раз превышавшего размер молекул белков, структуры которых к тому времени уже были расшифрованы. Только в 1962 г. на базе многочисленных исследований, проводившихся различными учеными, Родни Портер (Rodney Porter) расшифровал основную структуру антител, стало известно, что антитело состоит из легкой и тяжелой цепи. Позже Родни Портеру совместно с Джеральдом Эдельманом (Gerald Edelman) удалось определить последовательность 1300 аминокислот, входящих в белковую цепь антитела, производимого клетками раковой опухоли миеломы. В то время это была самая большая расшифровка аминокислотной последовательности, за что в 1972 году ученые получили Нобелевскую премию. В результате исследований Портера и Эдельмана стало известно, что антитело имеет форму буквы Y, в которой нижняя часть (тяжелая цепь) имеет постоянную структуру для разных антител, а плечи (легкие цепи) значительно различаются у различных антител. Именно эти плечи отвечают за связывание антитела с антигеном и его нейтрализацию.
(Рисунок 1. Структура антитела, за которую ученые Родни Портер и Джеральд Эдельман в 1972 г. получили Нобелевскую премию по физиологии и медицине)
К 1970-м годам уже были известны некоторые важные моменты о том, каким образом в организме человека вырабатываются антитела. В частности, было известно, что за продуцирование антител отвечают В-лимфоциты, причем каждый В-лимфоцит может вырабатывать только одно специфическое антитело, при этом он редуплицируется и за счет этого быстро производит большое количество идентичных по структуре антител — так называемых моноклональных, то есть произошедших от одной клетки-предшественницы.
Добиться столь же быстрой выработки антител в лабораторных условиях удалось в 1975 году ученым Георгу Кёлеру (Georges Köhler) и Сезару Мильштейну (César Milstein). На тот момент была исследована способность клеток раковой опухоли миеломы быстро производить идентичные самим себе клетки. Кроме того, существовала возможность выделения антителопродуцирующих клеток из организма животных. Технология Кёлера и Мильштейна включала несколько этапов: у мыши вырабатывался иммунитет к известному антигену, затем из ее селезенки выделялись антителопродуцирующие клетки, эти клетки с помощью особой технологии соединялись с клетками миеломы с получением гибридомы, клетки которой непрерывно в большом количестве синтезировали антитела против известного антигена. Эта методика произвела переворот в изучении антител, поскольку позволила получать антитела с удивительно точным соответствием определенной структуре. В дальнейшем технология была усовершенствована, и в 1984 году Кёлер, Мильштейн и датский иммунолог Нильс Ерне (Niels Jerne) получили Нобелевскую премию за участие в создании антител, которые можно использовать для диагностических исследований и создания лекарственных средств. В дальнейшем было разработано множество технологий, позволивших усовершенствовать синтез антител за счет развития технологий рекомбинации ДНК, технологий клонирования клеток и других достижений генной инженерии.
При первых попытках применения для лечения людей антител, искусственно синтезированных из клеток животных, ученые столкнулись с трудностями. В 1979 г. впервые в мире ученые Филип Сташенко (Philip Stashenko) и Ли Надлер (Lee Nadler) применили искусственно синтезированные моноклональные антитела, полученные из клеток мышей, против антигенов, которые вырабатываются на поверхности клеток раковых опухолей. Однако было выявлено, что мышиные антитела в незначительной степени связывались с опухолевыми антигенами и воспринимались организмом как чужеродные клетки.
С 1986 г. на фармацевтическом рынке началась реализация препарата компании Janssen «Ортоклон ОКТ3» (муромонаб), который позволяет купировать реакцию отторжения трансплантата почки, оказывая избирательное иммуноподавляющее действие. Препарат имеет полностью мышиное происхождение, то есть синтезируется мышиными гибридомами, полученными слиянием мышиной миеломы и мышиных В-лимфоцитов. Вскоре после выхода препарата на рынок стало ясно, что при длительном применении мышиных моноклональных антител в качестве лекарственных средств их эффективность снижалась. Это связано с тем, что мышиные белки являются иммуногенными для организма человека, то есть воспринимаются как чужеродные объекты. В связи с этим у пациентов, которым вводят мышиные антитела, быстро образуются человеческие антимышиные антитела (human antimurine antibody – HAMA). Образующиеся HAMA-антитела нейтрализуют эффект мышиных антител.
В начале 90-х гг. с использованием молекулярно-биологических методов, основанных на применении рекомбинантной ДНК, были созданы химерные антитела. В химерных антителах часть «мышиной» молекулы с помощью методов генной инженерии заменялась на участок человеческого происхождения, а часть оставалась фрагментом мышиного происхождения. Поскольку белковая последовательность химерных антител на 75% состояла из «человеческих» последовательностей аминокислот, то у пациентов, получавших химерные антитела, HAMA-антитела образовывались в значительно меньшем количестве, и это сделало препараты на основе химерных антител значительно более эффективными, чем на основе мышиных. В дальнейшем был выпущен целый ряд лекарственных средств на основе химерных антител: ритуксимаб, выпускаемый под брендами «Мабтера» и «Ритуксан», — для лечения раковых опухолей, «Ремикейд» (инфликсимаб) — для лечения болезни Крона, «Симулект» (базиликсимаб) — для профилактики острого отторжения трансплантата почки, «Реопро» (абциксимаб) — для профилактики стенокардии и острого инфаркта миокарда, а также другие препараты.
Разработка химерных антител позволила практически полностью отказаться от использования мышиных антител. Однако в некоторых случаях использование мышиных антител и сегодня остается оправданным. Из одобренных к применению лекарственных средств сегодня лишь три являются мышиными: «Ортоклон-ОКТ3» (муромонаб-CD3), «Зевалин» (ибритумомаб тиуксетан) и «Бексар» (тозитумомаб-йод 131). Два последних являются радиоактивно мечеными мышиными МАТ. Их функция заключается в доставке радиоизотопов к клеткам лимфомы. Наличие радиоактивной метки позволяет применять эти антитела в очень небольших количествах, поэтому иммуногенность, обусловленная мышиными последовательностями, в этом случае не так значима. То, что эти препараты включают именно мышиные, а не гуманизированные или человеческие формы делает их более эффективными, потому что гуманизированные формы могли бы связываться одновременно не только с клетками-мишенями, но и со здоровыми клетками, нанося им вред. Также к применению сегодня одобрен один препарат на основе крысино-мышиного МАТ — это препарат «Ремоваб» (катумаксомаб) для лечения злокачественного асцита.
Шестой шаг — создание гуманизированных и человеческих моноклональных антител (конец 90-х гг. XX в. — 2000-е гг. XXI в.)
В конце 90-х гг. с помощью методов генной инженерии удалось свести к минимуму процент мышиных последовательностей аминокислот в искусственно синтезируемых антителах, благодаря чему были получены гуманизированные антитела, еще в меньше степени вызывающие образование HAMA-антител у человека. Начиная с конца 90-х гг. на рынок было выпущено множество препаратов на основе гуманизированных антител.
Примеры препаратов на основе моноклональных антител:
- «Зенапакс» (даклизумаб) — для профилактики отторжения после трансплантации почки,
- «Герцептин» (трастузумаб) — для лечения рака молочной железы и рака желудка,
- «Ксолар» (омализумаб) — для лечения атопической бронхиальной астмы и сезонного аллергического ринита,
- «Раптива» (эфализумаб) — для лечения псориаза, а также многие другие.
В 2000-х годах усовершенствованные методы генной инженерии наконец позволили добиться долгожданного результата и получить человеческие МАТ. В настоящее время человеческие МАТ чаще всего получают с помощью технологии трансгенных мышей (мышей, выведенных с использованием фрагментов чужеродной ДНК) или фагового дисплея (особый метод генной инженерии с использованием вирусов-бактериофагов). Например, сегодня для клинического применения одобрены такие препараты, созданные на основе человеческих МАТ, как «Бенлиста» (белимумаб) — для лечения красной волчанки, «Ервой» (ипилимумаб) — для лечения меланомы, «Симпони» (голимумаб) — для лечения ревматоидного артрита, псориатического артрита, болезни Бехтерева, а также другие препараты.
Еще один тип веществ, созданных методами генной инженерии для лечения пациентов, — это так называемые «белки слияния», в которых искусственно соединены два отдельных белка, зачастую с различными функциями. Например, на основе такого вещества создан препарат «Амевив» (алефацепт) моноклональные антитела при псориазе, орфанный препарат «Аркалист» (рилонацепт) — для лечения редких генетических аутовоспалительных заболеваний, относящихся к группе криопинсвязанных периодических синдромов, и другие препараты.
Разработка лекарственного средства с использованием моноклональных антител — это очень длительный и дорогостоящий процесс. Например, первый препарат на основе мышиных антител «Ортоклон OKT3» был зарегистрирован в 1986 г., только через 11 лет после того, как мышиные антитела были впервые описаны. Первый препарат на основе химерного МАТ «Реопро» был одобрен в 1994 г., через 10 лет после первых работ по изучению химерных МАТ. Первый препарат на основе гуманизированного МАТ «Зенапакс» был утвержден в 1997 г., через 11 лет после первого доклада о конструкции гена гуманизированного антитела. Препарат «Энбрел» на основе слитых белков был одобрен в 1998 г., через 10 лет после описания «белков слияния». Препарат «Хумира» на основе человеческих МАТ был одобрен в 2002 году, через 12 лет после первой статьи о подобных МАТ.
Сегодня интерес к разработке новых препаратов на основе моноклональных антител со стороны производителей очень высок. В настоящее время на территории Российской Федерации стадию клинических исследований проходит более 10 препаратов на основе МАТ. Общее количество препаратов, находящихся на стадии разработки в мире, исчисляется сотнями.
Перед современными учеными, исследующими моноклональные антитела, стоит множество актуальных задач. В частности, поиск решения проблемы иммуногенности препаратов, изготовленных на основе МАТ. Большинство препаратов на основе МАТ, которые сегодня проходят стадию клинических исследований, включают в состав человеческие антитела. Использование этого типа антител снизило иммуногенность препаратов, однако не устранило проблему полностью, поскольку иммунная система человека способна вырабатывать антитела против любого терапевтического белка.
Еще одна проблема, связанная с применением препаратов на основе моноклональных антител, обусловлена тем, что МАТ представляют собой крупные молекулы, которые не способны проникать внутрь клетки или глубоко в ткани. Сегодня МАТ нельзя применять внутрь, так как их концентрация для достижения эффекта должна в несколько тысяч раз превышать концентрацию молекул-мишеней. В связи с этими особенностями, сегодня ученые озабочены созданием нового поколения лекарственных средств, которые объединят в себе преимущества МАТ и мелкомолекулярных препаратов. На этом пути сделано уже несколько важных научных открытий. Первое из них — создание шведской компанией Affibody особых «аффител», которые обладают свойствами обычных антител, но имеют в десятки раз меньшую молекулярную массу, что позволяет им лучше проникать в ткани. Еще одно достижение науки — разработка «нанотел» бельгийской компанией Ablynx. Эти препараты характеризуются высокой стабильностью, что позволяет использовать их внутрь и местно. Кроме того, они просты в производстве. Сейчас на стадии клинических исследований у пациентов с тромбозами и остеопорозом находятся четыре «нанотела». Наконец, еще одно сверхсовременное направление — разработка доменовых антител американской компанией Domantis. Эти антитела должны соответствовать различным отделам тяжелой и легкой цепи антител человека и быть в десять раз меньше обычного антитела, что позволит применять их внутрь и ингаляционно.
Пока что длительность и высокая стоимость производства лекарственных средств с использованием моноклональных антител делает их не всегда доступными для пациентов. Однако ученые работают над созданием новых технологий, которые позволят выпускать новые препараты быстрее и по более низкой стоимости. Благодаря современным технологиям, уже сегодня многие препараты стали доступными для большого количества пациентов и позволили излечить заболевания, ранее считавшиеся неизлечимыми. Можно надеяться, что в будущем спектр излечимых заболеваний еще более расширится, а лекарственные средства на основе моноклональных антител станут еще более эффективными.
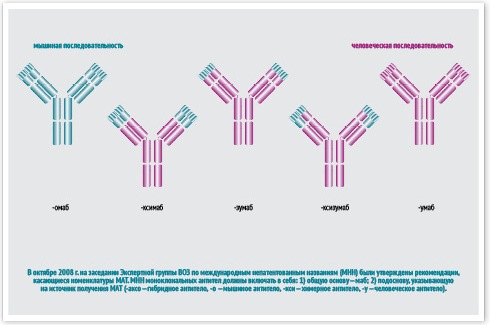
В октябре 2008 г. на заседании Экспертной группы ВОЗ по международным непатентованным названиям (МНН) были утверждены рекомендации, касающиеся номенклатуры МАТ. МНН моноклональных антител должны включать в себя:
- общую основу – маб;
- подоснову, указывающую на источник получения МАТ (-аксо — гибридное антитело, -о — мышиное антитело, -кси — химерное антитело, -у — человеческое антитело).
источник
1.Моноклональные антитела в диагностике и лечении.
Использование антител в иммуноферментном анализе
Успехи в профилактике и лечении различных заболеваний человека, животных или растений в значительной степени зависит от своевременности и точности определения вызвавшего его патогенного микроорганизма. Классические методы микробиологического анализа, несмотря на свою высокую точность, являются весьма длительными, трудоемкими и дорогими. Кроме того, не всегда удается культивировать такие патогенные микроорганизмы как внутриклеточные паразиты или вирусы, а результаты часто бывают ошибочными.
В последнее время для устранения этих принципиальных ограничений были разработаны методы, в основе которых лежат важнейшие достижения биохимии, иммунологии и генной инженерии.
Любой метод выявления патогенных микроорганизмов должен быть достаточно простым, быстрым и обладать высокой специфичностью и чувствительностью. Диагностический тест должен давать положительный ответ только на микроорганизм- или молекулу-мишень, обнаруживать очень малые количества такой мишени даже на фоне других микроорганизмов или молекул, загрязняющих образец. Простота метода подразумевает, что он является достаточно продуктивным, эффективным и недорогим для рутинного применения.
Одним из наиболее широко применимым методом является иммуноферментный анализ (ИФА) и прежде всего его разновидность- ферментный иммуносорбентный анализ (ELISA). Процедура его проведения включает следующие этапы (рис.1):
А. Фиксация (закрепление) компонентов анализируемого образца (сыворотка крови, образцы ткани, клетки микроорганизмов) на поверхности твердой подложки (лунки, планшетки).
Б. Добавление раствора антитела (первого антитела) специфичного к определенному, искомому антигену. Если он имеется в анализируемом образце, то произойдет его связывание с антителами. Далее лунку промывают с целью удаления несвязавшихся молекул первого антитела.
В. Добавление раствора другого антитела (второго антитела), способного специфически связываться с первым антителом. Лунку опять промывают для удаления несвязавшихся с первым антителом вторых антител. Второе антитело обычно представляет собой коньюгат (комплекс) с некоторыми ферментами, способными катализировать химические превращения определенных бесцветных веществ (субстратов), которые сопровождаются появлением цветной окраски или свечением (люминисценцией) при облучении УФ-лучами.
Г. Добавление раствора бесцветного субстрата. Если в лунке присутствует комплекс антиген-первое-второе антитела, то наблюдается окраска или свечение, по интенсивности которых судят о содержании искомого антигена и степени протекания болезни.

Основной принцип ELISA — специфическое связывание первого антитела с определенной молекулой-мишенью. В качестве такой мишени обычно выступает какой либо имуногенный белок патогенного микроорганизма или специфические белки человека, например антитела, свидетельствующие о протекании определенного паталогического процесса в организме. Очищенный препарат таких белков-антигенов используют для получения специфических антител, при помощи которых затем и выявляют данную мишень. Однако антитела, которые образуются в сыворотке (антисыворотке) крови иммунизированного животного (обычно кролика или мыши), могут связываться с разными антигенными детерминантами (участками, эпитопами) такой молекулы-мишени. Поэтому такую смесь антител называют поликлональным препаратом.
Использование поликлональных антител имеет два недостатка, существенных для методов имунодиагностики: 1) содержание отдельных антител в поликлональном препарате может варьировать от одной партии к другой, что не обеспечивает однозначности и воспроизводимости анализов; 2) поликлональные антитела нельзя применять, если необходимо различить две сходные мишени, т.е. когда имуногенный белок патогенной формы микроорганизма, например coli-бактерий, вызывающих кишечные инфекции, и непатогенных (E.coli) форм различаются единственной детерминантой. Однако эти проблемы вполне разрешимы, поскольку сейчас научились получать чистые препараты антител, выработанных к одной специфической антигенной детерминанте, т. е. препараты моноклональных антител. Применение моноклональных антител позволяет существенно повысить специфичность метода ELISA, поскольку они связываются с одним, строго определенным антигенным сайтом. К настоящему времени получен целый ряд моноклональных антител, на основе которых созданы диагностические системы, которые можно использовать для обнаружения различных соединений и патогенных микроорганизмов.
Моноклоналъные антитела
Поскольку использование сывороток крови животных для получения моноклональных антител невозможно, то для практического применения антител в качестве диагностического инструмента или компонентов терапевтических средств необходимо было найти или создать такую чистую линию клеток, которая длительно росла бы в культуре и продуцировала антитела одного типа, обладающие высоким сродством к специфическому антигену-мишени, — моноклональные антитела. Подобная клеточная линия могла бы стать неиссякающим источником идентичных молекул антител. К сожалению, β-лимфоциты (β-клетки), синтезирующие антитела, не могут воспроизводиться в культуре. Решение данной проблемы виделось в создании гибридной клетки. Получив генетическую составляющую от β-клетки, она могла бы вырабатывать антитела, а приобретя способность к делению от клетки совместимого типа — расти в культуре. Было известно, что β-лимфоциты иногда перерождаются и становятся раковыми (миеломными) клетками, приобретая способность к росту в культуре и сохраняя в то же время многие свойства β-клеток. Так клетки миеломы, в первую очередь те, которые не вырабатывают антител, стали кандидатами на слияние с антителопродуцирующими β-клетками. Технология слияния таких клеток была разработана в 1975 г. американскими учеными Г. Келером и С. Мильштейном.
источник
Моноклональные антитела — это новейшее достижение медицины, которое применяется при лечении тяжелых заболеваний. Среди них злокачественные новообразования, аутоиммунные, системные, заболевания сердечно-сосудистой системы, некоторые инфекции и многое другое. Помимо этого, моноклональные антитела широко используются в диагностике, например, в иммуногистохимии, иммуноферментном анализе, проточной цитофлуориметрии и др. Таким образом, данная технология используется во многих отраслях современной медицины.
Человечество уже давно открыло для себя действие антител — особых молекул, которые вырабатываются клетками иммунной системы для распознавания чужеродных агентов — антигенов и их уничтожения. Антитела обладают специфичностью. Это значит, что они узнают только свой антиген, причем не просто антиген, а отдельный его фрагмент — детерминантную группу. В одном антигене может быть несколько таких детерминантных групп, и к ним будут образовываться разные антитела. Более того, к одной детерминанте может образовываться сразу несколько видов антител, которые могут отличаться по структуре, степени родства и прочности связывания. Таким образом, при введении антигена в организм образуется большое количество разных видов антител, направленных исключительно на один вид антигена. Это позволяет обеспечить адекватную иммунную защиту.
Антитела образуются специальными антителообразующими клетками. Причем каждый их вид образуется отдельной группой генетически однородных клеток — клонов. Чем больше необходимо видов антител, тем больше образуется клонов. Соответственно, антитела, которые вырабатываются одним клоном клеток называются моноклональными антителами.
Раньше для производства антител применялась иммунизация животных, после которой отбиралась их плазма и использовалась для приготовления отдельных препаратов — иммунных сывороток для борьбы с различными токсинами (дифтерия, столбняк), вирусами, ядами и др. Но бывают ситуации, когда нужно конкретное антитело, направленное на конкретную детерминанту антигена. Здесь уже обычной иммунизацией не обойтись. Требуются более прицельные технологии.
Получение моноклональных антител — это сложный многоступенчатый процесс, который проходит следующие этапы:
- Иммунизация животных. Обычно используются мыши или крысы. Это нужно для того чтобы увеличить количество лимфобластов — клеток, продуцирующих нужные антитела и перевести эти клетки в активное состояние. После выделения из организма эти клетки не могут долго существовать в лабораторных условиях, они погибнут даже на питательных средах с содержанием ростовых факторов. Чтобы это предотвратить, их скрещивают со злокачественными миеломными клетками.
- Подготовка миеломных клеток. Параллельно с иммунизацией животных проводят подготовку опухолевых миеломных клеток. Они, во-первых, обладают способностью синтезировать моноклональные антитела, а во-вторых, обладают неограниченным жизненным потенциалом (они бессмертны и способны к бесконечному воспроизведению). Для того чтобы миеломные клетки не погибли вне организма, их культивируют на специальных средах с использованием факторов роста.
- Гибридизация (слияние) лимфобластов и миеломных клеток для образования гибридомы. Для этого клетки обрабатывают различными антителами, чтобы изменить строение их мембран и спровоцировать образование цитоплазматических контактов. При этом образуются разные типы клеток, имеющих двойной набор хромосом (дикарионы). Это могут быть дикарионы, образованные только лимфоцитами, или только миеломными клетками. Но для производства моноклональных антител нужны именно дикарионы, образованные лимфоцитом и миеломной клеткой — гибридные клетки.
- Отбор гибридных клеток. Для этого используют специальные растворы, которые позволяют выжить только лимфобластным и гибридомным дикарионам. Первые в скором времени погибают, т. к. не обладают возможностью безграничного деления, а гибридомные клетки остаются жизнеспособными.
- Реклонирование гибридомных клонов.
- Определение и отбор гибридом, продуцирующих моноклональные антитела. Обычно для этого используется иммуноферментный анализ.
- Массовое наращивание антител.
- Очистка полученных антител. Степень очистки будет определяться областью применения препарата. Если это диагностика, достаточно 70-95% степени чистоты. Если препарат предполагается использовать для иммунотерапии, требуется более высокая степень чистоты. Для очистки используется аффинная и ионообменная хроматография.
- Удаление оставшихся примесей и обеззараживание полученного препарата от вирусов и бактерий.
В настоящее время идет тенденция отказа в использовании антител животных для лечебных целей. Во-первых, они являются чужеродными агентами для организма и могут спровоцировать аллергические реакции, вплоть до анафилаксии, что напрямую угрожает жизни пациентов. Во-вторых, иммунная система человека, распознавая такие антитела как чужеродные, будет пытаться их инактивировать, что снизит эффективность противоопухолевого лечения. Получить человеческие моноклональные антитела вышеописанным методом не представляется возможным, ввиду следующих проблем:
- Иммунизация человека различными антигенами неэтична.
- Даже если получить иммунизированные лимфоциты человека, будут проблемы на этапе их слияния с клетками миеломы мыши — полученные гибридомы будут нестабильны.
- Клеточные линии миеломы человека, которые можно было бы эффективно использовать в рамках биотехнологий для получения антител, пока получить не удалось.
В этой связи необходимо было искать новые технологии получения антител. Решением проблемы стали гибридные, гуманизированные и одноцепочечные антитела, производство которых подразумевало применение гибридомной технологии, кратко описанной выше, и технологии рекомбинантной ДНК.
- Гибридное или химерное антитело — это антитело, в котором его константный домен заменен на иммуноглобулин человека. Получаются они посредством технологии рекомбинантной ДНК, когда удаляется фрагмент мышиной ДНК, отвечающей за синтез константного домена и меняют его на фрагмент человеческой ДНК. Таким образом, в антителе в качестве константного домена, который обладает иммуногенными и эффекторными свойствами, будет человеческий белок, что позволит организму воспринимать его «за своего», а вариабельный домен, который специфически взаимодействует с антигеном, останется мышиным. Все вместе это позволит сохранить специфичность и уменьшить аллергенность и иммуногенность применяемого препарата.
- Гуманизированное антитело содержит еще меньше мышиного белка за счет только антигенсвязывающих гипервариабельных участков вариабельного домена. Это еще больше снижает вероятность осложнений со стороны иммунной системы.
- Одноцепочечное антитело представляет собой минимальный фрагмент антитела, который еще в состоянии хорошо связаться с антигеном и оказать свое действие. Он не содержит константного домена вообще.
Моноклональные антитела широко используются в лечении заболеваний, у которых в патогенезе замешан иммунный компонент. С их помощью лечат псориаз, аутоиммунные заболевания, ревматоидный артрит, рассеянный склероз. Большие перспективы эти технологии получили и в онкологии в рамках таргетной терапии. При этом, их эффект основан на различных механизмах, которые рассмотрены ниже.
В качестве примера изменения клеточных сигналов можно привести рецепторы факторов роста. Некоторые злокачественные клетки имеют на своей поверхности большое количество рецепторов к факторам роста, активирующим каскад реакций, направленный на усиление размножения клетки. Чем больше таких рецепторов, тем активнее протекает этот процесс. Если блокировать рецептор с помощью моноклонального антитела, он не сможет связаться с лигандом (фактором роста), и соответственно каскад этих реакций не будет запущен. Клетка не будет так активно размножаться и в конце концов погибнет.
Этот механизм реализуется следующим образом. Антитело связывается с антигеном, находящимся на поверхности злокачественной клетки, что приводит к активации многоэтапной системы комплемента (механизма иммунного ответа). Конечным этапом этих реакций является образование особого белка С 9, который перфорирует клеточную мембрану раковой клетки, что в конечном итоге приводит к ее гибели.
Моноклональные антитела могут стимулировать иммунные клетки, например, макрофаги. Они будут распознавать клетки злокачественных опухолей и «пожирать» их, тем самым уничтожая их.
Одной из причин, по которой становится возможным образование и развитие злокачественной опухоли в организме, является то, что иммунная система человека не распознает такие клетки как чужеродные. Моноклональные антитела дают возможность иммунитету «познакомиться» с раком и делает его доступным для связывания и последующего уничтожения. Таким образом, организм получает возможность самостоятельно бороться с опухолью.
Препараты на основе моноклональных антител уже два десятилетия входят в протоколы противоопухолевого лечения некоторых злокачественных новообразований. В 2008 году ВОЗ были приняты рекомендации относительно непатентованных названий таких препаратов:
- Их название должно заканчиваться на маб, от английского monoclonal antibody.
- Для указания источника получения моноклонального антитела должны использоваться следующие подосновы:
-
- -аксо — гибридное антитело.
- -о — мышиное антитело.
- -кси — химерное антитело.
- -у — человеческое антитело.
В настоящее время используется два вида противоопухолевых моноклональных антител:
- Неконъюгированные антитела — они оказывают непосредственное действие на процессы, которые приводят к гибели злокачественной клетки.
- Конъюгированные антитела — они связаны (конъюгированы) с токсинами или изотопами. Токсины и изотопы обладают уничтожающим действием на злокачественные клетки, а антитело обеспечивает их прицельную доставку к клеткам-мишеням.
Эти препараты используются чаще всего. Их целью является определенный рецептор на поверхности злокачественной клетки.
К этому типу препаратов относится ритуксимаб — первое моноклональное антитело, которое было одобрено для применения в клинической практике. Его используют для лечения CD20+ В-клеточных лимфом. Рецептор CD20 есть на В-лимфоцитах, как здоровых, так и опухолевых, но он отсутствует на других тканях и клетках, в том числе на стволовых. Поэтому при воздействии ритуксимаба хоть и погибает популяция В-лимфоцитов, но потом она восстанавливается за счет нетронутых стволовых клеток. Причем восстанавливаются именно здоровые клетки.
Неконъюгированные антитела могут помечать злокачественные клетки и делать их видимыми для иммунной системы. Таким способом работает алемтузумаб, который связывается с CD52+ лимфоцитами и привлекает к ним внимание иммунитета.
Также к неконъюгированным моноклональным антителам относятся ингибиторы рецепторов факторов роста. Факторы роста — это специальные молекулы, которые запускают деление клетки. Для того чтобы запустить этот процесс, фактор должен связаться со специальным рецептором, расположенным на мембране клетки, что приведет к каскаду соответствующих реакций. Такие рецепторы есть и у здоровых клеток, и у злокачественных, но у злокачественных их может быть очень много, что позволяет таким клеткам делиться быстрее. Блокирование рецепторов с помощью антител приводит к нарушению этого процесса деления и клетки уже не могут бесконтрольно размножаться. К таким препаратам относится трастузумаб, цетуксимаб и др.
К неконъюгированным антителам относятся и ингибиторы ангиогенеза — образования кровеносных сосудов. Ангиогенез очень важен для злокачественных опухолей, чтобы получать большее количество кислорода и питательных элементов, поэтому опухоли инциируют его образование с помощью специальных химических сигналов. Моноклональные антитела либо блокируют передачу этих сигналов, либо разрушают уже созданную внутри опухоли сосудистую сеть. Это приводит к нарушению ее питания и остановке роста. К группе этих препаратов относится рамуцирумаб, бевацизумаб и др.
Конъюгированные моноклональные антитела связывают с цитотоксическими или радиотоксическими веществами, что позволяет прицельно воздействовать разрушающим агентом на злокачественные клетки. В качестве примера такого препарата можно привести ибритумомаб (Зевалин), в котором моноклональное антитело против CD20 (как мы помним, это маркер В-лимфоцитов) соединено с радиоактивным изотопом — иттрием-90. Препарат применяется для лечения В-клеточных лимфом. В качестве другого препарата можно привести Кадсилу — препарат, в котором антитело трастузумаб конъюгировано с ингибитором микротрубочек DM1, оказывающим цитотоксический эффект. Применяют его для лечения рака молочной железы.
Несмотря на, казалось бы, огромные перспективы в лечении онкологических больных, применение моноклональных антител не является панацеей и тоже имеет ряд проблем:
- Препараты на основе моноклональных антител биологически и биохимически нестабильны. Особенно это касается конъюгированных антител. Это требует особых условий производства, хранения и транспортировки.
- Антитела плохо проникают внутрь опухоли.
- Они могут вызывать иммунный ответ против себя, что блокирует их действие. У 75% пациентов, которым вводились мышиные антитела, наблюдалось образование нейтрализующих антител, что снижало эффективность лечения.
- Препараты на основе моноклональных антител оказывают токсическое действие. Конечно, оно не такое выраженное как у цитостатиков, но в ряде случаев токсичность настолько высокая, что требует отмены препарата.
- Наиболее важным моментом является высокая специфичность моноклональных антител и высокая гетерогенность опухолевых клеток. Не все раковые клетки имеют молекулы мишени, на которые направлено действие препарата. Соответственно, они ускользают от его действия и остаются нетронутыми. Постепенно масса этих клеток накапливается и опухоль становится резистентной к данному методу лечения.
Чтобы улучшить результаты лечения, разрабатываются новые виды моноклональных антител. Одним из вариантов являются биспецифические антитела, которые направлены сразу на две молекулярные мишени, например, блинатумомаб — препарат, направленный сразу на две клеточные мишени В-лимфоцита — CD 19 и CD22. Он повышает узнаваемость злокачественных клеток даже после их трансформации в другие виды лейкоза.
В любом случае моноклональные антитела — это новое и высокоперспективное направление в современной онкологии. Разработка современных, более совершенных технологий помогает решать имеющиеся проблемы и делает лечение пациентов эффективнее и безопаснее.
источник
Моноклональные антитела, которые можно выработать против практически любого природного антигена, широко используются как в молекулярной биологии и биохимии, так и в медицине.
Эта статья посвящена замечательному достижению современной иммунологии — методу гибридóм. Соматический гибрид нормальной антителообразующей и опухолевой клеток (гибридóма) дает потомство, обладающее бессмертием опухолевой клетки и способностью к синтезу антител, унаследованному от клетки нормальной. Гибридомы продуцируют огромное количество моноклональных антител, обладающих уникальной специфичностью.
Целое поколение лекарств, направленных на терапию и лечение тяжелых заболеваний (таких как рак), основано на моноклональных антителах. Так человек пока неловко, но все более и более уверенно пытается использовать в свое благо замечательное изобретение природы — приобретенный иммунитет. «Биомолекула» публикует статью известного российского ученого Гарри Израилевича Абелева, посвященную истокам технологии моноклональных антител, — методу гибридóм (первый вариант этой статьи был опубликован в Соросовском образовательном журнале [1]). Статья дополнена выпускницей биофака МГУ Олиферовой Жанной, которая рассказывает о современных способах получения моноклональных антител, шагнувших дальше гибридомной методики. — Ред.
При введении в организм животных и человека чужеродных макромолекулярных веществ — белков или полисахаридов (антигенов) в крови появляются защитные белки — антитела, для которых характерна необыкновенная, уникальная специфичность. Каждое антитело узнает только свой антиген, точнее, одну его детерминантную группу. Детерминантная группа состоит из нескольких остатков аминокислот или сахаров (обычно из 6–8), образующих пространственную структуру, характерную для данного белка. В одном белке, состоящем из нескольких сот аминокислот, имеется несколько (5–15) разных детерминант, поэтому к одному белку образуется целое семейство различных по своей специфичности антител. Даже к одной детерминанте образуется целый спектр антител, отличающихся по структуре, степени специфичности и прочности связывания с ней. То же относится и к полисахаридным антигенам, детерминантные группы которых образуются 3–6 остатками моносахаридов.
Таким образом, при введении антигена возникает большое семейство антител, направленных к разным его детерминантам и различающихся также внутри группы антител, направленных к одной и той же детерминанте. В крови иммунизированных животных появляется богатый и уникальный по составу спектр антител, который и обеспечивает их абсолютную специфичность в распознавании данного антигена.
Антитела давно и широко используются для нейтрализации бактериальных токсинов (дифтерийного, столбнячного), змеиных ядов (кобры, гадюки), вирусов, попавших в кровь (особенно эффективно для вируса кори), и для идентификации индивидуальных белков (и других антигенов), находящихся в клетке или сложнейших тканевых экстрактах. Однако иногда требуются не многокомпонентные смеси антител, возникающие в крови в ответ на введение антигена, а отдельные, элементарные составляющие этой смеси, направленные лишь к одной детерминанте антигена и имеющие одни и те же характеристики. Такие антитела бывают нужны как для изучения их собственной природы, так и для практического использования, например для доставки в опухоли токсических веществ.
Очевидно, что путем иммунизации, то есть введением животному индивидуального антигена или только одной его детерминантной группы, это сделать, как правило, невозможно. Почему? Дело в том, что в организме в процессе созревания антителообразующих клеток (АОК) образуется большое количество (миллионы) генетически однородных семейств клеток — клонов, каждый из которых специализируется на синтезе только одного варианта антител, и в этом причина большого разнообразия антител, индуцируемых даже одним антигеном. Таких клонов много больше, чем требуется антител для распознавания любого, случайно взятого антигена. Антиген, попадая в организм, стимулирует размножение тех клонов, которые продуцируют антитела к его детерминантам.
Казалось бы, выход прост: надо вырастить отдельные клоны антителообразующих клеток in vitro — в культуре тканей — и они будут продуцировать моноклональные антитела, то есть антитела одной строго определенной специфичности, продукт одного клона. Но и это оказалось невозможным: нормальные клетки смертны, вскоре после высаживания в культуру они погибают. Дело не доходит до образования клонов АОК. Добавление в культуру факторов роста несколько продлевает их жизнь, но тоже не решает проблемы.
Путь решения проблемы неожиданно указали злокачественные опухоли. Уже давно известны опухоли у человека — плазмоцитомы, вырабатывающие и секретирующие в кровь иммуноглобулины, по структуре своей неотличимые от антител. Причем каждое такое «антитело» слегка отличалось от другого, вырабатываемого другой плазмоцитомой. Образовывалась как бы коллекция случайных антител к неизвестным антигенам. Когда накопились сотни таких «антител», и они были испытаны с сотнями наугад взятых антигенов, оказалось, что в этой коллекции обнаружились специфически реагирующие пары «антиген—антитело».
Почему именно опухоли указали на возможность получения моноклональных антител? Есть несколько причин, и все они коренятся в самой природе опухолевой клетки. Она всегда (или почти всегда) сохраняет свойства и функции клетки, из которой произошла. Плазмоцитома происходит из «юных» плазматических клеток, то есть как раз из тех клеток, которые синтезируют антитела. Это свойство сохраняется в опухолях, возникших из соответствующих клеток. Очень важной особенностью опухолей является их возникновение из одной генетически измененной (мутантной) клетки. Поэтому опухоль возникает и развивается как клон, в нашем случае как клон иммуноглобулинобразующих клеток. Причем они образуют строго однородный по всем свойствам моноклональный иммуноглобулин.
Нормальные плазматические клетки (или их предшественники — лимфоциты) смертны, их срок жизни — несколько дней. Опухоль, и в этом ее принципиальное отличие от нормальных предшественников, бессмертна (См. также: «Бессмертные клетки Генриетты Лакс»). Ее можно культивировать в пробирке или пересаживать от одного животного другому неограниченное число раз и в течение неограниченного времени. В отличие от нормальной ткани опухоль автономна; организм «хозяина» неспособен (за очень редкими исключениями) остановить неограниченный рост злокачественного опухолевого клона. Плазмоцитомы возникают не только спонтанно, то есть непредсказуемо: их можно довольно легко индуцировать у мышей и крыс и получить бессмертный, неограниченно растущий, перевиваемый клон клеток, продуцирующих иммуноглобулины, иногда обладающие специфичностью антител, причем антител моноклональных. Вполне естественно было желание иммунологов научиться получать плазмоцитомы, продуцирующие антитела заданной специфичности. Для этого мышей вначале интенсивно иммунизировали, а затем индуцировали у них плазмоцитомы, чтобы получить опухоли и из тех клонов, которые производили антитела к антигенам, использованным для иммунизации, но это практически не удавалось.
Слишком редки были совпадения. Тогда попробовали индуцировать опухоли антителообразующих клеток опухолеродными вирусами. Результаты были лучше, однако создать простой и универсальный метод получения моноклональных антител на этом пути также не оказалось возможным.
Успех пришел, как всегда, неожиданно, как побочный продукт исследования, имевшего иные цели. В начале 70-х годов молодой немецкий иммунолог Жорж Кёлер, получивший стипендию для работы в знаменитом Базельском институте иммунологии, заинтересовался вопросом о генетической изменчивости антител. В то время можно было ожидать, что антитела мутируют (генетически изменяются) с бóльшей частотой, чем другие белки. Для исследования надо было изолировать клон АОК, продуцирующий антитела определенной специфичности, получить из него стабильную клеточную линию, поддерживаемую в пробирке (в культуре), и проследить, с какой частотой появятся там генетически измененные варианты. Для реализации проекта Кёлер поехал в Англию, в лабораторию Сезара Мильштейна, изучавшего клоны плазмоцитом, и они вместе разработали оригинальный подход к этой проблеме: решили получить гибрид нормальной АОК и опухолевой клетки. В случае успеха такой гибрид унаследовал бы от нормальной клетки способность к синтезу антител, а от опухолевой — бессмертие и способность к неограниченному и бесконтрольному росту. Это им удалось осуществить.
Методы гибридизации соматических (то есть не половых) клеток к тому времени были хорошо известны и широко применялись для разных целей. Для этого использовали вирус, способствующий слиянию клеток. Разнородные клетки, у которых слились оболочки, образовывали двуядерные гибриды, которые сохраняли способность к клеточным делениям. В процессе клеточного деления хромосомы обоих ядер перемешивались и образовывали общее ядро. Таким образом, возникал истинный гибрид, потомок двух соматических клеток, или гибридóма. Гибридому можно получить и между нормальной АОК и опухолевой, плазмоцитомной клеткой. Плазмоцитома была взята потому, что она больше всего соответствовала АОК по типу дифференцировки: весь ее синтетический аппарат был настроен на синтез иммуноглобулинов. Проблема заключалась в том, как отделить заданную гибридому от присутствующих в системе отдельных неслившихся клеток и от гибридов иного состава или иной специфичности, чем требуемые.
Для достижения этой цели авторы разработали специальную схему, использующую отбор клеток в селектирующей среде. Прежде всего был получен особый мутант мышиной плазмоцитомы, рост которого можно было контролировать составом питательной среды. Для получения мутанта использовали особенности синтеза нуклеиновых кислот (ДНК и РНК), имеющихся во всех клетках и необходимых для их существования. Известно, что имеются два пути синтеза предшественников нуклеиновых кислот: основной и резервный. Основной — это путь новообразования нуклеотидов (звеньев, входящих в состав нуклеиновых кислот). Этот путь включает несколько этапов и блокируется противоопухолевым препаратом аминоптерином (А). Однако клетки не гибнут от этого препарата, поскольку обладают резервным путем — способностью синтезировать нуклеотиды и нуклеиновые кислоты, реутилизируя продукты распада ранее синтезированных нуклеиновых кислот: гипоксантина (Г) и тимидина (Т). Добавление Г и Т в питательную среду, содержащую А, снимает токсический эффект последнего.
Для селекции гибридом надо было получить мутант плазмоцитомы, не способный пользоваться резервным путем и, следовательно, погибающий в среде, содержащей Г, A и T (ГАТ-среда). Такой мутант получили путем добавления в среду токсических аналогов Г и Т. Все клетки, способные усваивать Г и Т, включали их токсичные аналоги и погибали. Выживали лишь те редкие мутанты, которые были неспособны усваивать Г и Т, то есть были лишены резервного пути. Из потомства этих клеток дополнительно отбирали еще и такие мутанты, которые утратили способность к синтезу собственных иммуноглобулинов. Теперь все было готово для получения гибридом, то есть гибридов нормальных АОК и плазмоцитомных клеток (рис. 1).
Рисунок 1. Схема получения гибридом. Условные обозначения: А, В, С — многокомпонентная смесь антигенов, использованная для иммунизации; АОК — антителообразующие клетки селезенки; Пл — клетки плазмоцитомы, не растущие в селективной ГАТ-среде; ПЭГ — полиэтиленгликоль; ГАТ — среда, содержащая гипоксантин, аминоптерин, тимидин; анти-А, анти-В, анти-С — моноклональные антитела соответственно к А-, В-, С-антигенам.
Мышей интенсивно иммунизировали определенным материалом — белком, бактериальной клеткой или клеткой животного происхождения. Когда в их крови появлялись антитела, у них брали селезенку и лимфатические узлы (места скопления АОК), и из них готовили взвесь клеток. К ней добавляли в избытке клетки мутантной плазмоцитомы и полиэтиленгликоль (ПЭГ). После короткой инкубации, требующейся для слияния клеток, их отмывали от ПЭГа и помещали в среду, содержащую Г, Т и А (ГАТ-среда). Теперь в системе находились гибриды АОК и АОК, АОК и плазмоцитомы, а также оставшиеся свободными АОК и клетки плазмоцитомы. Из них нужно было отобрать только гибриды АОК и плазмоцитомы. После недолгого (несколько дней) культивирования одиночные АОК, а также гибриды АОК и АОК погибали, так как нормальные клетки смертны и быстро погибают в культуре.
Плазмоцитомные клетки и их гибриды также погибали, так как А блокировал основной путь синтеза предшественников нуклеиновых кислот, а Г и Т их не спасали. Выживали, следовательно, только гибриды АОК и плазматических клеток, так как бессмертие они унаследовали от плазмоцитомы, а резервный путь — от нормальной клетки. Такие гибриды — гибридомы — сохраняли способность синтезировать и секретировать антитела.
Рисунок 2. Иммунофлуоресцентное окрашивание клетки соединительной ткани (фибробласта) моноклональным антителом к тубулину — белку микротрубочек, образующих скелет клетки.
Следующий этап после получения гибридом — клонирование и отбор нужных клонов. Выжившие в ГАТ клетки рассевали в специальные пластиковые планшеты, содержащие обычно 96 лунок емкостью примерно по 0,2 см 3 . В каждую лунку помещали в среднем по 10 гибридомных клеток, которые культивировали в присутствии «кормящих» клеток, не имеющих отношения к гибридомам, но способствующих их росту. После нескольких дней культивирования содержимое каждой лунки проверяли на присутствие антител нужной специфичности. Для этого использовали микрометоды выявления антител к соответствующему антигену. Клетки из лунок, содержащих нужные антитела, клонировали (то есть повторно рассевали по таким же лункам, но из расчета 1 клетка на лунку), вновь культивировали и проверяли на присутствие нужных антител. Процедуру повторяли 1–2 раза. Таким образом, отбирали клоны, продуцирующие антитела только одной нужной специфичности, то есть моноклональные антитела [2]. Полученные клоны можно заморозить при −70 °С и хранить до того, пока они не потребуются. Их можно культивировать и накапливать антитела в культуральной среде, а можно привить мышам (так как гибридомы — это опухолевые клетки), где они будут расти и накапливать колоссальные количества моноклональных антител. От одной мышки можно получить антител не меньше, чем от кролика. Эти антитела не содержат посторонних антител и настолько однородны физико-химически, что могут рассматриваться как чистые химические реактивы.
Рисунок 3. Последовательные срезы через желудок (жел) и пищевод (пищ) мыши, окрашенные двумя моноклональными антителами: 1 — первое моноклональное антитело реагирует с эпителием пищевода и слабее с эпителием желудка; 2 — второе моноклональное антитело реагирует только с эпителием желудка.
Обычные поликлональные антитела давно и широко применяются для определения биологически активных веществ — белков крови и других биологических жидкостей, гормонов, ростовых факторов, клеточных рецепторов, медиаторов воспаления и иммунитета, бактериальных и вирусных антигенов, различных ядов и т.п. Моноклональные антитела из-за высочайшей специфичности, стандартности и технологичности получения успешно вытесняют и заменяют иммунные сыворотки.
Далее гибридомы создают уникальные возможности в аналитических целях: их можно применять как «иммунологический микроскоп» с чрезвычайно высоким разрешением. Так, например, если нужно сравнить две клеточные линии, отличающиеся одним или немногими антигенами, и надо выявить такие антигены, то метод гибридом предоставляет для этого исключительные возможности. Проиммунизировав мышей одной из линий и получив сотни гибридом, продуцирующих антитела к антигенам этой линии, можно найти одну или две с антителами только к данной линии. Размножив такую гибридому в пробирке или вырастив ее на мышах, можно получить огромное количество антител к уникальному антигену (или детерминантной группе), затерянному среди других компонентов клетки подобно иголке в стоге сена. Это будет продукт одного клона. В крови иммунизированного животного среди множества других антител он никак не проявится из-за чисто количественных отношений. Благодаря же гибридомам его можно не только обнаружить, но и вывести в линию и получить любое количество соответствующих антител. С помощью гибридом можно обнаружить антигены, характерные для опухолей определенных тканей, получить к ним антитела и использовать их для диагностики и типирования опухолей. Такие моноклональные антитела нашли широкое применение в онкологической клинике. Наконец, во всем мире ведутся активные исследования по использованию моноклональных антител в качестве специфических переносчиков токсических веществ в опухолевые клетки. Пока же с помощью моноклональных антител в опухоль и ее метастазы доставляются радиоактивные вещества, позволяющие обнаружить небольшие узелки опухоли по локализации в них радиоактивности.
Гибридомы сыграли и продолжают играть огромную роль в фундаментальной и прикладной иммунологии. Они созданы на основе клонально-селекционной теории иммунитета [3] и явились самым ярким и окончательным доказательством этой теории. Гибридомы сделали реальностью предполагаемые клоны антителообразующих клеток и позволили даже обнаружить их существование в организме до введения соответствующего антигена. Гибридомы революционизировали иммунологическую промышленность и создали в ней совершенно новые области. Благодаря гибридомам возникли новые методы диагностики многих заболеваний и открылись новые пути для изучения злокачественных опухолей. И хотя гибридомы скорее относятся к гениальным изобретениям, а не к открытиям, они были отмечены в 1984 году Нобелевской премией «за открытие и разработку принципов выработки моноклональных антител с помощью гибридом». Если бы Кёлер и Мильштейн запатентовали свой метод, они вскоре бы стали миллиардерами, так как все, кто использовал бы гибридомы в коммерческих целях, должны были бы платить за право пользоваться патентом. Авторы гибридом, несомненно, понимали это, но в интересах развития науки не пошли на такой шаг. Метод гибридом беспрепятственно вошел во все сферы иммунологии, и сами авторы всемерно способствовали этому, предоставляя свою клеточную линию плазмоцитомы для исследований всем желающим. И первые гибридомы в нашей стране, полученные в 1979–1980 годах, были созданы на основе клеток, ведущих происхождение из лаборатории этих авторов и с их любезного разрешения.
Первоначально статья была опубликована в Соросовском образовательном журнале [1], позже — на сайте автора.
Автор дополнительной главы — Жанна Олиферова.
В 1975 году, когда Кёлер и Мильштейн опубликовали статью о методе получения гибридом [4] и предположили, что этот метод может быть использован в медицине и промышленности, мало кто верил в возможность практического применения моноклональных антител. Как ни курьёзно это сейчас звучит, в ответе, полученном Мильштейном из национальной корпорации по исследованиям и разработкам в 1976 году, была фраза: «Нам, несомненно, трудно сейчас определить непосредственные практические применения [метода гибридом], которые имели бы коммерческий потенциал. » [5]. В наши дни моноклональные антитела стали одним из необходимых реагентов в биологической лаборатории, а объёмы продаж лекарств, созданных на их основе, превышают миллиарды долларов [6]. Развитие каких технологий сделало возможным такое широкое их применение? Этот раздел статьи посвящен истории создания популярного современного метода получения моноклональных антител, который пришёл на смену технологии гибридом, и виртуозному применению синтетических моноклональных антител для решения научных проблем.
Описанный выше метод гибридом позволил получать неограниченное количество моноклональных антител, специфичных к одной детерминантной группе. Их широкое применение в медицине и иммунологии поставило новые задачи:
- Мышиные антитела плохо подходят для использования в клинической практике — они вызывают иммунный ответ в организме человека точно так же, как введённый антиген приводит к выработке антител у мышей, из-за чего они быстро удаляются из организма. Стремление создать полностью человеческие антитела для клинической практики стало стимулом для разработки новых технологий.
- Иммунизация — необходимое условие для получения гибридомы, но не все молекулы могут легко активировать АОК. Например, они могут быть слишком токсичны для введения мышам. Каждая гибридома производит антитело только к одной детерминанте, но не всегда можно выбрать антитела с необходимой специфичностью к нужному белку даже из большого количества гибридом. Например, у исследователя могут быть такие требования к антителам: специфически связываться только с одним из двух похожих белков или узнавать только одну конформацию белка. Получить такие антитела при помощи метода гибридом очень трудно, потому что при иммунизации антитела могут вырабатываться к антигенным детерминантам, которые одинаковы у двух белков, так как они расположены на поверхности и более доступны для связывания антител. Требовался новый метод, который бы позволил получать антитела нужной аффинности и специфичности, не прибегая к иммунизации мышей.
Появление такого метода стало возможном благодаря развитию нескольких научных направлений. Прежде всего этому способствовал прогресс в понимании структуры и функции антител. Какой механизм обусловливает высокую аффинность и специфичность антител, которые производит гибридома? Во время дифференцирования B-лимфоцитов (в процессе соматической генетической рекомбинации) нуклеотидная последовательность гена, кодирующего вариабельный домен B-клеточного рецептора, собирается из нескольких сегментов (рис. 4). Эта последовательность уникальна у каждой B-клетки, как и рецепторы на её поверхности. Когда B-клетка узнаёт свой антиген, она активируется и становится АОК, часть из которых сразу начинает производить антитела низкой аффинности. Рецепторы других АОК проходят процесс аффинного созревания, в результате которого аффинность и специфичность рецептора АОК, а, следовательно, и антител, повышается.
Рисунок 4. Строение антител. Каждое антитело состоит из двух тяжёлых (Heavy) и двух легких (Light) цепей. Тяжелые цепи образованы вариабельным доменом (Variable Heavy) и тремя константными доменами (Constant Heavy 1, CH2, CH3). Лёгкие цепи содержат один вариабельный (Variable Light) и один константный (Constant Light) домен. Один вариабельный и один константный домен, соединённые дисульфидной связью, составляют Fab-фрагмент.
Сайт связывания антигена образован вариабельными доменами одной тяжёлой и одной лёгкой цепи. Участок антигена, который распознается антителом, называется эпитопом. Взаимодействующий с ним фрагмент поверхности антитела называют паратопом. Справа на рисунке показан вид «сверху» на паратоп антитела, специфичного к трансмембранному белку вируса иммунодефицита человека. Паратоп образован участками, определяющими комплементарность (complementarity-determining regions, CDR) вариабельных доменов. Каждый вариабельный домен содержит три таких CDR-участка, относящихся к тяжелой цепи ( CDRH1 , CDRH2 , CDRH3 ), и три — к легкой ( CDRL1 , CDRL2 , CDRL3 ).
Аффинное созревание основано на соматической гипермутации, в процессе которой в последовательности вариабельных доменов рецепторов специальные белки вносят 1–5 мутаций на каждое деление клетки. Большинство мутаций приводит к тому, что B-клетка перестает узнавать антиген и погибает. Редкие мутации повышают аффинность рецептора к антигену (такие мутации накапливаются в CDR-участках), и B-клетки, несущие такие рецепторы, выживают, размножаются и производят антитела с высокой аффинностью и специфичностью [7], [8]. К сожалению, этот процесс ещё недостаточно хорошо изучен, чтобы его можно было контролировать в пробирке и таким образом получать антитела с нужной специфичностью.
Развитие методов генной инженерии привело к появлению новых возможностей: вариабельные и константные участки генов, кодирующих антитела, можно комбинировать в пробирке, вносить в них мутации, отбирать необходимые варианты и экспрессировать в бактериях. Так можно получать антитела с нужными свойствами, не иммунизируя мышей. Для того чтобы это стало реальностью, сначала надо было создать библиотеки вариабельных доменов антител. Начало этому было положено в 1989 году, когда соответствующие гены были выделены из пяти гибридом и из активированных клеток селезёнки иммунизированных мышей. Эти гены были клонированы, и были определены их нуклеотидные последовательности. В настоящее время для создания библиотек используют вариабельные домены наивных (неактивированных) лимфоцитов мышей или человека и даже комбинируют фрагменты природных вариабельных доменов с синтезированными человеком [9].
В 1988 году Fab-фрагмент антитела впервые был экспрессирован в бактерии. Чтобы создавать антитела без использования гибридом, оставалось решить последнюю задачу: физически связать между собой антитело и кодирующий его ген, тогда выбрав из библиотеки антитело, специфичное к данной молекуле, можно клонировать его ген для экспрессии в бактерии и получать нужное количество антител. В 1990 году Г. Винтер и соавторы встроили в геном бактериофага нуклеотидную последовательность Fab-фрагмента антитела, объединив его с частью гена поверхностного белка III этого фага [10]. Это позволило экспрессировать на поверхности каждой вирусной частицы несколько копий этого гибридного белка, сохраняющего специфичность к своему антигену, — а значит, можно было проводить селекцию нужного антитела из фаг-дисплейной библиотеки (рис. 5). Один раунд селекции может увеличить частоту фага, специфичного к данному антигену, в 1000 раз. За несколько раундов можно из большой популяции выделить редкие фаги, специфичные к данному антигену, извлечь из них ДНК, определить нуклеотидную последовательность и клонировать для получения антител в бактерии.
Рисунок 5. Фаг-дисплейные библиотеки. Бактериофаги, несущие миллионы различных фрагментов антител, наносят на колонку, содержащую нужный антиген (1). После отмывания ненужных фагов (2), те, которые связывают данный антиген (3), снимают с колонки и размножают в бактериях (4). Нуклеотидная последовательность отобранных фагов может быть модифицирована (5), после чего мутированные фаги размножают в бактериях (6) и повторяют процесс селекции (7).
Кристаллографические структуры комплексов антиген—антитело позволили понять принципы организации, стоящие за кажущимся бесконечным разнообразием природных антител [11], [12]. Например, за исключением CDR-участков, структура антител довольно консервативна: известно всего несколько десятков различных структур, некоторые из которых более стабильны и встречаются в природных антителах чаще. При создании современных фаг-дисплейных библиотек выбирается одна наиболее стабильная структура вариабельных доменов тяжёлой и легкой цепи, разнообразие аминокислотных остатков CDR-участков создаётся искусственно [12]. Анализ природных антиген-связывающих сайтов антител выявил, что наиболее часто непосредственно взаимодействуют с поверхностью антигена аминокислотные остатки тирозин (Tyr) и серин (Ser), поэтому первые библиотеки синтетических антител получали, варьируя именно эти остатки в ключевых позициях CDR. В последующих поколениях библиотек начали варьировать также остатки, которые не взаимодействуют с поверхностью антигена непосредственно, но влияют на конформацию CDR-участков. Современные библиотеки содержат более 10 миллиардов фрагментов антител с уникальной специфичностью [12].
Пример успешного применения фаг-дисплейных библиотек — создание моноклональных антител, специфичных к различным конформациям белка убиквитина [13], [14]. В клетке встречаются полимеры убиквитина, связанные через боковые цепи разных остатков лизина (Lys). Lys48-связанные полимеры «помечают» белки, предназначенные для деградации в протеасомах, а Lys63-связанные цепи играют важную роль во многих клеточных процессах, — например, способствуют образованию сигнальных платформ рецепторов, включая рецептор фактора некроза опухолей 1 и рецептор интерлейкина 1 (ИЛ-1) (рис. 6). Для исследования убиквитиновых модификаций применялись дорогостоящие и трудоёмкие методы (такие как масс-спектроскопия), которые не позволяли следить за их быстрыми изменениями. Моноклональные антитела, специфично узнающие разные конформации полимеров убиквитина, стали бы незаменимым реагентом для исследования многих клеточных процессов. Долгое время попытки получить такие антитела были безуспешны.
Рисунок 6. Роль К63- и К48-связанных полимеров убиквитина в передаче сигнала от рецептора фактора некроза опухолей. Слева: К48- (вверху) и К63-связанный убиквитин (внизу) и их условные обозначения. Справа: Адаптерный белок RIP1 связывается с активированным рецептором, модификация К63-убиквитином важна для образования сигнальной платформы (5 мин). Через 10 мин деубиквитиназа А20 заменяет К63-связанные полимеры убиквитина на К48-связанные полимеры, что приводит к деградации сигнального комплекса. Антитела, узнающие две конформации убиквитина, показаны разными цветами.
Вишва Диксит и соавторы использовали фаг-дисплейные библиотеки для получения специфичных антител к Lys48- и Lys63-связанным полимерам убиквитина [15]. После четырех раундов из библиотеки были отобраны фрагменты антител, которые не связывались с моноубиквитином и были специфичны исключительно к Lys63- или Lys48-связанным полимерам, причем с наномолярной аффинностью. Выбранные антитела экспрессировали в бактериях и определили их аминокислотные последовательности. У антител к Lys48-связанным полимерам убиквитина вариабельность аминокислотных остатков была сконцентрирована в CDRH3, поэтому для повышения их аффинности в этот же участок внесли дополнительные мутации. Полученные после повторного отбора антитела к Lys48-связанным полимерам обладали очень высокой аффинностью (1,2 нМ).
Оптимизация антител к Lys63-связанным цепям потребовала, напротив, значительных усилий. Сначала, перед повторным отбором, мутации были внесены в CDRH1 и CDRH2, но аффинность полученных антител была на порядок ниже, чем у антител к Lys48-связанным цепям убиквитина. Для дальнейшей оптимизации была получена пространственная структура К63-связанных димеров убиквитина в комплексе с антителами, которая показала, что значительная часть паратопа составлена аминокислотными остатками CDRH2 и CDRL2, в которые и были внесены дополнительные мутации. Отобранные антитела имели высокое сродство к Lys63-связанному полимеру (6–7 нМ) и не связывались с другими конформациями убиквитина. Кристаллическая структура нового комплекса показала, что мутированные аминокислотные остатки не контактируют с поверхностью убиквитина, а повышение специфичности объясняется улучшением электростатической совместимости между поверхностями антигена и антитела.
Полученные антитела могут быть использованы для иммунопреципитации белков, модифицированных различными полимерами убиквитина, из клеточных лизатов, или для иммуннофлуоресцентного окрашивания клеток, что позволяет получить информация о пространственной организации модифицированных белков. С их помощью исследователям удалось проследить за быстрыми изменениями модификаций адаптерных белков в сигнальном каскаде, инициированном рецептором фактора некроза опухолей (ФНО) на поверхности клетки. Через пять минут после связывания ФНО со своим рецептором, киназа RIP1, модифицировнная К63-связанными полимерами убиквитина, связывается с рецептором. К63-полимеры убиквитина необходимы для взаимодействия с другими белками и передачи сигнала. Уже через 10 минут деубиквитиназа А20 начинает заменять К63- на К48-полимеры убиквитина, что приводит к деградации сигнального комплекса и прекращению сигнала (рис. 6). Такая же замена Lys63- на Lys48-связанные полимеры убиквитина происходит и во время передачи сигнала от других рецепторов, таких как рецептор ИЛ-1 и некоторых Толл-рецепторов. Время передачи сигнала варьирует в зависимости от рецептора: в случае рецептора ИЛ-1 замена K63→K48 происходит только через 30–60 минут после связывания лиганда [15].
Приведённый пример показывает, что развитие современных методов производства моноклональных антител превратило их в чрезвычайно точный научный инструмент, с помощью которого будет сделано ещё немало интересных открытий.
источник